
【題目】下列敘述不正確的是( )
A. 丙烯與氯化氫加成的產物有2種 B. 聯二苯![]() 的二氯取代物有15種
的二氯取代物有15種
C. 立方烷![]() 的六氯取代物有3種 D. 分子式為CCl2F2的物質只有一種空間結構
的六氯取代物有3種 D. 分子式為CCl2F2的物質只有一種空間結構
 口算小狀元口算速算天天練系列答案
口算小狀元口算速算天天練系列答案科目:高中化學 來源: 題型:
【題目】短周期的5種主族元素A、B、C、D、E,原子序數依次增大。A、B、C三種元素原子電子層數之和是5;B原子的最外層電子數是其電子層數的2倍;D的一種單質是一種有特殊臭味的淡藍色氣體,可用于殺菌消毒;E與A在同一主族。
請回答下列問題:
(1)A與E可形成化合物甲,甲與水反應可生成H2,寫出甲的電子式:__________________。
(2)甲與AlCl3反應得到NaAlH4,甲與NaAlH4都是重要的還原劑,寫出NaAlH4與水發生反應的化學方程式:____________________________________。
(3)某同學認為;用惰性氣體趕盡反應體系中的空氣,將鐵和鹽酸反應后的氣體經濃硫酸干燥,再與E的單質反應,得到固體物質即為純凈的甲;取該固體物質與水反應,若能產生H2;即可證明得到的甲一定是純凈的。判斷該同學設想的制備和驗純方法的合理性并說明理由:____________________________________。
(4)C元素的氣態氫化物也具有一定的還原性,寫出其與CuO反應的化學力程式:____________________________________。
(5)B、D、E組成的一種鹽中,B的質量分數為17.91%,其水溶液能使酸性高錳酸鉀溶液褪色,寫出該鹽的化學式:_______________。常溫下,該鹽的水溶液中離子濃度由大到小的順序為:____________________________________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】碲及其化合物是半導體材料。
(1)25℃時,H2TeO3(亞碲酸):Ka1=1.0×10-3、Ka2=2.0×10-8。在該溫度下,0.1mol·L-1H2TeO3溶液的pH約為_____________(填代號)。
A.0.7 B.1 C.2 D.5
NaHTeO3溶液中,H2TeO3、HTeO3-、TeO32-濃度大小的排序為____________________。
(2)工業上,常用銅陽極泥(主要成分是Cu2Te,含少量的Ag、Au)冶煉碲,其工藝流程如下(已知TeO2微溶于水,易與濃強堿.濃強酸反應):
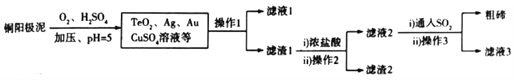
①銅陽極泥溶于硫酸時加壓的目的是_____________________________________________;
若調節pH時,pH過低,則粗碲產率會_____________(填“增大”“減小”或“不變”)。
②上述流程中可以循環利用的物質是____________________。
③寫出銅陽極泥轉化成TeO2的化學方程式:___________________________________________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】鋅錳干電池是最早的實用電池。現用下列工藝回收正極材料中的金屬(部分條件未給出)。
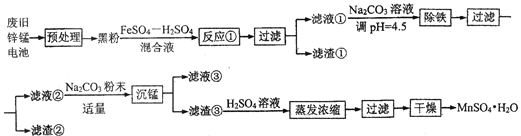
(1)堿性鋅錳電池反應為:Zn+2MnO2+2H2O=Zn(OH)2+2MnO(OH),電解質是KOH,該電池的負極材料為__________(填化學式),MnO(OH)中Mn的化合價為:________,正極反應式為:__________。
(2)黑粉的主要成份為 MnO2和石墨,寫出反應①的化學方程式:______。
(3)MnO2的轉化率與溫度的關系如下表:
溫度/℃ | 20 | 40 | 60 | 80 | 100 |
轉化率/℃ | 86.0 | 90.0 | 91.3 | 92.0 | 92.1 |
生產中常選反應溫度為80℃,其理由是:_______。
(4)“沉錳”過程中生成堿式碳酸錳[MnCO36Mn(OH)25H2O],寫出其離子反應方程式:_______,檢驗沉淀是否洗凈的操作是:_______。濾液③中可回收的物質為:________(填化學式)。
(5)“預處理”時,廢舊鋅錳電池經過拆解、篩分得到炭包,其中含 MnO2為34.8%。稱取5.000 g炭包,經處理得到3.211 g MnSO4H2O,計算錳的回收率為:_____。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】C60具有完美的球形結構。之后Si60、N60等球形分子被不斷制備出來。回答下列問題:
(1)Si的核外電子排布式為_______,C和N元素中第一電離能較大的是_______。
(2)富勒烯衍生物具有良好的光電性能,富勒烯(C60)的結構如右圖所示,C60屬于___晶體;C60分子中五元環與六元環的數目比為_____。
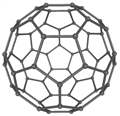
(已知簡單多面體的頂點數V、棱數E及面數F間有如下關系:V-E+F=2)。
(3)N60的晶體中存在的作用力有_____(填字母標號)
A.共價鍵 B.離子鍵 C.氫鍵
D.范德華力 E.配位鍵 F.金屬鍵
(4)立方氮化硼(BN)可做磨料,其結構與金剛石相似,二者具有相似性結構的原因是_______。
(5)金屬M(相對原子質量為m)與N60形成的化合物晶體結構如右圖所示(其中白球代表N60,黑球代表金屬M),若其晶胞邊長為k pm,NA代表阿伏加德羅常數的值,則其密度為______g·cm-3,該化合物中N60的配位數為______。

查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】常溫下,pH均為2、體積均為V0的HA、HB、HC溶液,分別加水稀釋至體積為V,溶液pH隨lg![]() 的變化關系如圖所示,下列敘述錯誤的是
的變化關系如圖所示,下列敘述錯誤的是

A. 常溫下:Ka(HB)>Ka(HC)
B. HC的電離度:a點<b點
C. 當lg![]() =4時,三種溶液同時升高溫度,
=4時,三種溶液同時升高溫度, ![]() 減小
減小
D. 當lg![]() =5時,HA溶液的pH為7
=5時,HA溶液的pH為7
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】某原電池反應原理如圖所示,下列說法正確的是
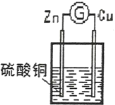
A. 在溶液中,SO42-移向正極 B. 在溶液中,電子從鋅片流向銅片
C. 一段時間后,溶液顏色變淺 D. 負極電極反應式為:Cu2++2e-=Cu
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】
(1)在一個1L的密閉容器中,加入2molA和1 mol B,發生下列反應:
2A(g) + B(g) ![]() 3C (g) + D(s),達到平衡時C的濃度為1.2 mol/L。
3C (g) + D(s),達到平衡時C的濃度為1.2 mol/L。
①維持容器的溫度不變,若縮小容器的體積,則平衡向(填“正反應方向”、“逆反應方向”或“不”)移動。
②維持容器的體積和溫度不變,按下列四種配比作為起始物質,達到平衡后,C的濃度仍是1.2 mol/L的是(填序號);
A.4 mol A+2 mol B
C.2 mol A+1 mol B+3 mol C
B.3 mol C+2molD
③達平衡后若升高溫度,B的濃度增加,則正反應的△H(填“>”、“<”或“=”)0。
(2)下圖1 mol NO2和1 mol CO反應生成CO2和NO中,CO和NO的濃度隨時間變化的示意圖。回答下列問題:
①從反應開始到t1時刻,用NO2濃度變化表示平均反應速率v(NO2)=。
②此溫度下該反應的平衡常數K=。
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com