
【題目】硫化氫的轉化是資源利用和環境保護的重要研究課題。將H2S和空氣的混合氣體通入FeCl3、FeCl2和CuCl2的混合溶液中回收S,其轉化如圖所示(CuS不溶于水)。下列說法中,不正確的是( )

A.過程①中,生成CuS的反應為H2S+Cu2+=CuS↓+2H+
B.過程②中,Fe3+作氧化劑
C.轉化圖中化合價不變的元素只有銅和氯
D.回收S的總反應為2H2S+O2=2H2O+2S↓
【答案】C
【解析】
由圖可知:一共發生的有三個反應①H2S+Cu2+=CuS↓+2H+;②CuS+2Fe3+=2Fe2++Cu2++S;③4Fe2++4H++O2=4Fe3++2H2O,由此可以推出總反應 2H2S+O2=2S↓+2H2O,再結合氧化還原反應中的基本概念解題。
A.根據圖中轉化可知,生成CuS的反應為H2S + Cu2+=CuS↓+ 2H+,A正確;
B.過程②中,Fe3+轉化為Fe2+,Fe3+為氧化劑,B正確;
C.結合分析中的三個方程式,轉化過程中化合價不變的元素除了有銅、氯之外還有氫,C錯誤;
D.根據圖中轉化可知,反應物為H2S和O2,生成物為S,根據原子守恒,還有水生成,總反應是2H2S+O2=2H2O+2S↓,D正確;
故選C。


科目:高中化學 來源: 題型:
【題目】NA是阿伏加德羅常數的值,下列說法正確的是( )
A.常溫常壓下,3.2gO2中氧分子數為0.1NA
B.標準狀況下,22.4L正己烷中碳原子數為6NA
C.78gNa2O2在足量CO2中充分反應轉移的電子數約為2NA
D.密閉容器中,3molH2和1molN2充分反應后氨分子數為2NA
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】1-溴丙烷是一種重要的有機合成中間體。實驗室制備少量1-溴丙烷的主要步驟如下:
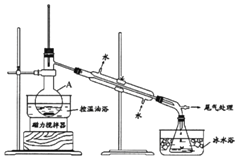
步驟1:在儀器A中加入攪拌磁子、12g 1-丙醇及20mL水,在冰水冷卻下緩慢加入28mL濃H2SO4;冷卻至室溫,攪拌下加入24g NaBr。
步驟2:緩慢加熱,直到無油狀物餾出為止。
步驟3:將餾出液轉入分液漏斗,分離出有機相。
步驟4:將分離出的有機相轉入分液漏斗,依次用H2O、5%的Na2CO3溶液洗滌,分液,得粗產品,進一步提純得1-溴丙烷。
已知:①1-溴丙烷沸點為71℃,密度為1.36g/cm3;
②反應過程中,在儀器A中可以觀察到A的上方出現紅棕色蒸氣(Br2)。
回答下列問題:
(1)儀器A的名稱是______;加入攪拌磁子的目的是攪拌和______。
(2)儀器A中主要發生反應為:NaBr + H2SO4===HBr + NaHSO4和______。
(3)步驟2中需向接收瓶內加入少量冰水并置于冰水浴中的目的是______,同時可以觀察到的現象是______。
(4)步驟4中的兩次洗滌,依次洗去的主要雜質是______、_________。
(5)步驟4中的Na2CO3溶液還可以用下列中的______試劑代替。
A.NaOH溶液 B.NaI溶液 C.Na2SO3溶液 D.CCl4
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】三氧化二鈷(Co2O3)主要用作顏料、釉料、磁性材料、催化劑和氧化劑等。以含鈷廢料(主要成分為Co2O3,含有少量MnO2、NiO、Fe3O4)為原料制備Co2O3的流程如下圖所示:

已知:
Ⅰ.“酸浸”后的浸出液中含的陽離子有H+、Co2+、Fe3+、Ni2+等。
Ⅱ.部分陽離子以氫氧化物形式沉淀時溶液的pH如下表:
沉淀物 | Fe(OH)3 | Co(OH)2 | Ni(OH)2 |
完全沉淀時的pH | 3.7 | 9.0 | 9.2 |
回答下列問題:
(1)“酸浸”含鈷廢料的溫度不宜過高,原因是_____________。
(2) “酸浸”時發生的主要反應是___________________(寫離子方程式)。
(3)某萃取劑對金屬離子的萃取率與溶液pH的關系如圖所示:
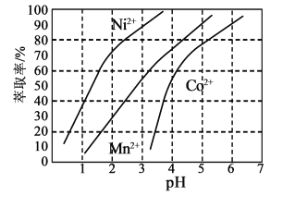
使用該萃取劑時應控制的pH約為____________,理由是_____________。
(4)寫出高溫煅燒時發生的化學反應方程式___________。
(5)操作1得到的副產品是__________(填名稱);
已知該物質的溶液加熱到100℃時會變質,該物質的溶解度見下表:
濕度 | 0℃ | 10℃ | 20℃ | 30℃ | 40℃ | 50℃ | 60℃ |
溶解度 | 70.6 | 73.0 | 75.4 | 78.0 | 81.0 | 84.5 | 88.0 |
操作1是________(填字母)。
a.蒸發結晶 b.降溫結晶 c.減壓蒸發結晶
(6)有機相提取的Ni2+再生時可用于制備鎳氫電池,該電池充電時的總反應為Ni(OH)2+M=NiOOH+MH,則放電時負極的電極反應式為_________________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】如圖是氯化銫晶體的晶胞(晶體中的最小重復單元),已知晶體中兩個最近的Cs+離子核間距離為a cm,氯化銫的相對分子質量為M,NA為阿伏加德羅常數,則氯化銫晶體密度是( )

A. ![]() g/cm3 B.
g/cm3 B. ![]() g/cm3 C.
g/cm3 C. ![]() g/cm3 D.
g/cm3 D. ![]() g/cm3
g/cm3
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】(1)晶體的自范性即__________,區分晶體與非晶體最可靠的實驗方法是________;
(2)原子間通過共用電子對所形成的相互作用叫做共價鍵。δ鍵與π鍵都屬于共價鍵,δ鍵的特征是__________,Π鍵的特征是__________。
(3)Li2O是離子晶體,其晶格能可通過下圖的BomHaber循環計算得到。
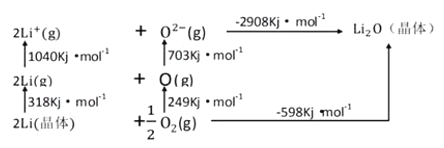
可知,Li原子的第一電離能為__________kJ/mol,O=O鍵鍵能為______kJ/mol,Li2O的晶格能為_________ kJ/mol。
(4)晶體硼的基本結構單元都是由硼原子組成的正二十面體的原子晶體。其中含有20個等邊三角形和一定數目的頂角,每個頂角各有一個原子,試觀察圖形回答。這個基本結構單元由_______個硼原子組成,共含有__________個BB鍵。
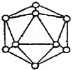
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】由1-氯丁烷制取少量的1,2-丁二醇時,需要經過下列哪幾步反應
A. 加成→消去→取代B. 消去→加成→水解
C. 取代→消去→加成D. 消去→加成→消去
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】I.為粗略測定質量為Wg的電石中CaC2的質量分數,利用電石與飽和食鹽水反應,實驗裝置如圖所示:
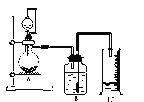
(1)燒瓶中發生反應的化學方程式是_____________
(2)產生的氣體分子的中心原子的雜化軌道類型是____________
(3)實驗測得量筒中水為VmL,該溫度下氣體摩爾體積為24.5 L/mol,則電石中CaC2質量分數為___________________
II.俄國化學家馬爾柯夫尼柯夫因為提出碳碳雙鍵的加成規則而聞名于世,該規則是指不對稱的烯烴與HX或HCN加成時,氫總是加到含氫較多的雙鍵碳原子上。
已知:![]()
以下是F的合成路線,請填寫下列空白:
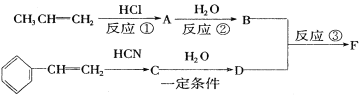
(1)寫出C的結構簡式______________
(2)B核磁共振氫譜共有__________________組氫
(3)寫出③的化學方程式______________
(4)將F與含酚酞的NaOH溶液混合,加熱一段時間后,可觀察到的顏色變化是__________________
(5)若某有機物G是D的同系物,相對分子質量比D少14,則其分子式為:________;其同分異構體中含苯環且能使石蕊試液變紅的物質共有______________種
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】根據雜化軌道理論和價層電子對互斥模型,判斷下列分子或者離子的空間構型正確的是
選項 | 分子式 | 中心原子雜化方式 | 價層電子對互斥模型 | 分子或離子的立體構型 |
A | SO2 | sp | 直線形 | 直線形 |
B | HCHO | sp2 | 平面三角形 | 三角錐形 |
C | H3O+ | sp2 | 四面體形 | 平面三角形 |
D | NH4+ | sp3 | 正四面體形 | 正四面體形 |
A. AB. BC. CD. D
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com