
【題目】由 Al、CuO、Fe2O3 組成的混合物共 10.0g,放入 500mL 某濃度鹽酸溶液中,混合物完全溶解,當再 加入 250mL 2.0mol/L 的 NaOH 溶液時,得到的沉淀最多。該鹽酸的濃度為( )
A. 0.5 mol/L B. 3.0 mol/L C. 1.0 mol/L D. 2.0 mol/L
科目:高中化學 來源: 題型:
【題目】H2O2分解速率受多種因素影響。實驗測得70℃時不同條件下H2O2濃度隨時間的變化如圖所示。下列說法正確的是( )

A. 圖甲表明,其他條件相同時,H2O2濃度越小,其分解速率越快
B. 圖乙表明,其他條件相同時,溶液PH 越小,H2O2分解速率越快
C. 圖丙表明,少量Mn2+存在時,溶液堿性越強,H2O2分解速率越快
D. 圖丙和圖丁表明,堿性溶液中,Mn2+對H2O2分解速率的影響大
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】電解質溶液的電導率越大,導電能力越強。用0.100 mol·L-1的NaOH溶液滴定10.00 mL濃度均為0.100 mol·L-1 的鹽酸和CH3COOH溶液。利用傳感器測得滴定過程中溶液的電導率如圖所示。下列說法正確的是( )
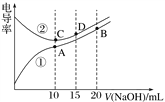
A. 曲線①代表滴定HCl溶液的曲線
B. A點溶液中:c(CH3COO-)+c(OH-)-c(H+)=0.1 mol·L-1
C. 在相同溫度下,A、B、C三點溶液中水的電離程度:C<B<A
D. D點溶液中:c(Cl-)=2c(OH-)-2c(H+)
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】化合物H是一種用于合成γ-分泌調節劑的藥物中間體,其合成路線流程圖如下:

(1)C中的含氧官能團名稱為_______和__________。
(2)D→E 的反應類型為__________________________。
(3)寫出同時滿足下列條件的C的一種同分異構體的結構簡式:_____________________。 ①含有苯環,且分子中有一個手性碳原子;②能發生水解反應,水解產物之一是α-氨基酸,另一水解產物分子中只有2種不同化學環境的氫。
(4)G 的分子式為C12H14N2O2 ,經氧化得到H,寫出G的結構簡式:__________________。
(5)已知: ![]() (R代表烴基,R'代表烴基或H) 請寫出以
(R代表烴基,R'代表烴基或H) 請寫出以![]() 和(CH3)2SO4為原料制備
和(CH3)2SO4為原料制備![]() 的合成路線流程圖(無機試劑任用,合成路線流程圖示例見本題題干) __________________。
的合成路線流程圖(無機試劑任用,合成路線流程圖示例見本題題干) __________________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】工業上有一種方法是用CO2來生產燃料甲醇。為探究反應原理,現進行如下實驗,在體積為l L的密閉容器中,充入lmol CO2和3mol H2,一定條件下發生反應:CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g) △H = —49.0 kJ·mol-1。
CH3OH(g)+H2O(g) △H = —49.0 kJ·mol-1。
測得CO2和CH3OH(g)的濃度隨時間變化如圖所示。
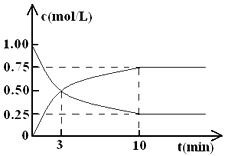
(1)從反應開始到平衡,氫氣的平均反應速率v( H2 )= ________ ,CO2的轉化率=________。
(2)該反應的平衡常數表達式k=__________ 。
(3)下列措施中能使n(CH3OH)/n(CO2)增大的是_________________ (填編號)。
A.將H2O(g)從體系中分離B.充入He(g),使體系壓強增大
C.升高溫度 D.再充入lmolCO2和3molH2
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】工業上通常用工業酒精和生石灰混合蒸餾法制取無水乙醇。如圖是實驗室中模擬工業原理制取無水乙醇的裝置。

回答下列問題:
(1)指出圖中的幾處錯誤:____________________________。
(2)在除去工業酒精中的水時,下列做法不可取的是____________。
A.加入過量的生石灰后過濾
B.加入過量的生石灰后蒸餾
C.加入過量的生石灰后分液
(3)由(2)可知除去工業酒精中的水的原理是(用化學方程式表示):_____________。
(4)裝置中儀器A、B、C的名稱分別是:A____________;B_______________;C_____________。
(5)在蒸餾操作中,儀器B中加入沸石(或碎瓷片)的作用是_________________________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】標準狀況下有①6.72 L CH4 ②3.01×1023個HCl ③13.6 g H2S ④0.2 mol NH3,下列對四種氣體的關系表示不正確的是
A. 體積④<①<③<② B. 密度①<④<③<②
C. 質量④<①<③<② D. 氫原子數④<②<③<①
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】實驗室欲用NaOH固體配制1.0 mol·L-1的NaOH溶液240 mL:
(1)配制溶液時,一般可以分為以下幾個步驟:
①稱量 ②計算 ③溶解 ④搖勻 ⑤移液 ⑥洗滌 ⑦定容 ⑧冷卻
其正確的操作順序為____________________。
(2)本實驗用到的玻璃儀器有________________(至少回答3個)。
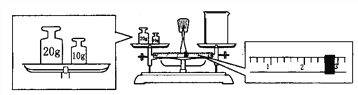
(3) 某同學欲稱量NaOH的質量,他先用托盤天平稱量燒杯的質量,天平平衡后的狀態如圖。燒杯的實際質量為________g,要完成本實驗該同學應稱出______g NaOH。
(4)在配制過程中,其他操作都是正確的,下列操作會引起所配溶液濃度偏高的是_____(填序號)
①沒有洗滌燒杯和玻璃棒
②轉移溶液時不慎有少量灑到容量瓶外面
③容量瓶不干燥,含有少量蒸餾水
④定容時俯視刻度線
⑤定容后塞上瓶塞反復搖勻,靜置后,液面低于刻度線,再加水至刻度線。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】常壓下羰基化法精煉鎳的原理為:Ni(s)+4CO(g)![]() Ni(CO)4(g)。230℃時,該反應的平衡常數K=2×105。已知:Ni(CO)4的沸點為42.2℃,固體雜質不參與反應。
Ni(CO)4(g)。230℃時,該反應的平衡常數K=2×105。已知:Ni(CO)4的沸點為42.2℃,固體雜質不參與反應。
第一階段:將粗鎳與CO反應轉化成氣態Ni(CO)4;
第二階段:將第一階段反應后的氣體分離出來,加熱至230℃制得高純鎳。
下列判斷正確的是
A. 增加c(CO),平衡向正向移動,反應的平衡常數增大
B. 第二階段,Ni(CO)4分解率較低
C. 第一階段,在30℃和50℃兩者之間選擇反應溫度,選50℃
D. 該反應達到平衡時,v生成[Ni(CO)4]=4v生成(CO)
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com