
【題目】氨水是氨氣的水溶液,主要用作化肥。現有25℃時0.1 mol/L的氨水,請回答以下問題:
(1)若向氨水中加入少量硫酸銨固體,此時溶液中的c(NH4+)_________,溶液的pH_________(填“增大”“減小”“不變”)。
(2)若向氨水中加入稀硫酸,使其恰好中和,寫出反應的離子方程式:____________;所得溶液的pH_________7(填“>”、“<”或“=”),用離子方程式表示其原因________。
(3)若向氨水中加入pH=1的硫酸,且氨水與硫酸的體積比為1:1,則所得溶液中各離子的物質的量濃度由大到小的順是_______
(4)實驗室可用向濃氨水中加入CaO的方法制取氨氣,從氨水中存在的平衡入手分析產生NH3的原因:__________
【答案】增大 減小 NH3·H2O+H+=NH4++H2O < NH4++H2O![]() NH3·H2O+H+ c(H+)>c(SO42-)>c(NH4+)>c(OH-) NH3(g)+H2O(l)
NH3·H2O+H+ c(H+)>c(SO42-)>c(NH4+)>c(OH-) NH3(g)+H2O(l)![]() NH3·H2O(aq)
NH3·H2O(aq)![]() NH4+(aq)+ OH-(aq),加入CaO后溫度升高,OH-濃度增大,平衡逆向移動,NH3逸出
NH4+(aq)+ OH-(aq),加入CaO后溫度升高,OH-濃度增大,平衡逆向移動,NH3逸出
【解析】
(1)硫酸銨電離出NH4+而導致溶液中c(NH4+)增大,結合一水合氨電離平衡分析溶液中c(OH-),再根據水的離子積常數及pH與溶液中c(H+)關系分析判斷;
(2)根據酸、堿發生中和反應的物質的量關系,結合電解質強弱書寫離子方程式,產生的鹽(NH4)2SO4是強酸弱堿鹽,利用鹽的水解規律,結合溶液中c(OH-)、c(H+)關系分析;
(3)pH=1的硫酸中c(H+)=0.1 mol/L,二者等體積混合,恰好完全反應生成硫酸氫銨,結合鹽的電離、銨根離子水解可知導致溶液呈酸性,分析比較溶液中離子濃度關系;
(4)根據CaO與水反應,消耗溶劑,反應放出熱量,從溫度、物質的濃度改變分析平衡移動。
(1)氨水是氨氣的水溶液,存在電離平衡:NH3·H2O![]() NH4++H+,向氨水中加入(NH4)2SO4,鹽電離產生NH4+,使溶液中c(NH4+)增大,對電離平衡起抑制作用,導致NH3·H2O電離程度減小,最終達到平衡時溶液中c(OH-)減小,由于溫度不變,Kw不變,所以溶液中c(H+)增大,由于pH=-lgc(H+),所以溶液pH減小;
NH4++H+,向氨水中加入(NH4)2SO4,鹽電離產生NH4+,使溶液中c(NH4+)增大,對電離平衡起抑制作用,導致NH3·H2O電離程度減小,最終達到平衡時溶液中c(OH-)減小,由于溫度不變,Kw不變,所以溶液中c(H+)增大,由于pH=-lgc(H+),所以溶液pH減小;
(2)向氨水中加入硫酸,二者發生中和反應產生(NH4)2SO4和水,反應的離子方程式為:NH3·H2O+H+=NH4++H2O;由于(NH4)2SO4是強酸弱堿鹽,在溶液中NH4+發生水解反應:NH4++H2O![]() NH3·H2O+H+,破壞了水的電離平衡,最終達到平衡時溶液中c(H+)>c(OH-)溶液顯酸性,所以溶液的pH<7;
NH3·H2O+H+,破壞了水的電離平衡,最終達到平衡時溶液中c(H+)>c(OH-)溶液顯酸性,所以溶液的pH<7;
(3)若向氨水中加入pH=1的硫酸,且氨水與硫酸的體積比為1:1,則二者恰好發生反應產生NH4HSO4,鹽在溶液中發生電離作用:NH4HSO4=NH4++H++SO42-,在溶液中NH4+發生水解反應:NH4++H2O![]() NH3·H2O+H+,使c(NH4+)減小,小于c(SO42-);c(H+)增大,大于c(SO42-);根據水的離子積常數不變,可知c(OH-)減小,而c(SO42-)不變,鹽電離作用遠大于水電離作用,所以c(NH4+)>c(OH-);故溶液中各種離子濃度關系為:c(H+)>c(SO42-)>c(NH4+)>c(OH-);
NH3·H2O+H+,使c(NH4+)減小,小于c(SO42-);c(H+)增大,大于c(SO42-);根據水的離子積常數不變,可知c(OH-)減小,而c(SO42-)不變,鹽電離作用遠大于水電離作用,所以c(NH4+)>c(OH-);故溶液中各種離子濃度關系為:c(H+)>c(SO42-)>c(NH4+)>c(OH-);
(4)氨水中存在平衡:NH3(g)+H2O(l)![]() NH3·H2O
NH3·H2O![]() NH4++H+,向其中加入CaO,會發生反應:CaO+H2O=Ca(OH)2,消耗溶劑水,使平衡逆向移動,CaO與水的反應是放熱反應,會使溶液溫度升高,加快NH3·H2O分解放出NH3;且Ca(OH)2是強堿,電離產生OH-,使溶液中c(OH-)增大,也會使平衡逆向移動,導致NH3逸出。
NH4++H+,向其中加入CaO,會發生反應:CaO+H2O=Ca(OH)2,消耗溶劑水,使平衡逆向移動,CaO與水的反應是放熱反應,會使溶液溫度升高,加快NH3·H2O分解放出NH3;且Ca(OH)2是強堿,電離產生OH-,使溶液中c(OH-)增大,也會使平衡逆向移動,導致NH3逸出。


 名校課堂系列答案
名校課堂系列答案科目:高中化學 來源: 題型:
【題目】氯化銅晶體(CuCl2·2H2O)中含有FeCl2雜質,為制得純凈的氯化銅晶體,首先將其制成水溶液,再按下圖所示的操作步驟進行提純。
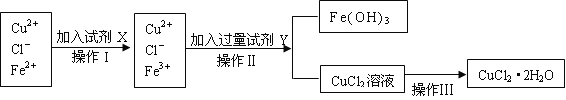
請參照下表給出的數據填空。
氫氧化物開始沉淀時的pH | 氫氧化物沉淀完全時的pH | |
Cu2+ | 4.7 | 6.7 |
Fe2+ | 7.0 | 9.0 |
Fe3+ | 1.9 | 3.7 |
(1)操作I加入X的目的是_________________。
(2)下列物質都可以作為X,適合本實驗的X物質可以是(填選項)_________ 。
A、KMnO4 B、NaClO C、H2O2 D、Cl2
(3)操作II的Y試劑為____________(填化學式),并調節溶液的pH在______范圍。
(4)實驗室在配制CuCl2溶液時需加入少許_________(填物質名稱),理由是(文字敘述并用有關離子方程式表示)_________________ __________。
(5)若將CuCl2溶液蒸干灼燒,得到的固體是_________________(填化學式);若要得無水CuCl2,請簡述操作方法_________________________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】已知A~G是幾種烴分子的球棍模型,據此回答下列問題:
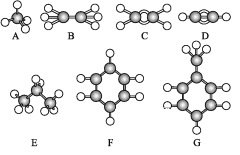
(1)上述七種烴中:
①常溫下含碳量最高的氣態烴是____(填結構簡式)。
②能夠發生加成反應的烴有____種。
③與A互為同系物的是____(填對應字母)。
④一鹵代物種類最多的是____(填對應字母)。
(2)寫出C發生加聚反應的化學方程式:____。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】水的電離平衡曲線如圖所示,下列說法不正確的是( )
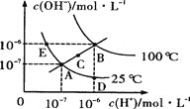
A.圖中五點Kw間的關系B>C>A=D=E
B.若從A點到D點,可采用在水中加入少量酸的方法
C.若處在B點時,將pH=2的硫酸與pH=12的KOH等體積混合后,溶液顯堿性
D.若從A點到C點,可用溫度不變時在水中加入適量NH4Cl固體的方法
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】甲~辛等元素在周期表中的相對位置如表。甲與戊的原子序數相差3,戊的一種單質是自然界硬度最大的物質,丁與辛屬同周期元素,下列判斷正確的是
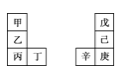
A.丙與庚的原子序數相差3
B.氣態氫化物的熱穩定性:戊>己>庚
C.乙所在周期元素中,其簡單離子的半徑最大
D.常溫下甲的單質在水中反應要比乙劇烈很多
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】氯堿工業以電解精制飽和食鹽水的方法制取氯氣、氫氣、燒堿和氯的含氧酸鹽等系列化工產品。如圖是離子交換膜法電解食鹽水的示意圖,圖中的離子交換膜只允許陽離子通過。
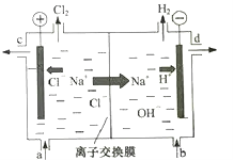
完成下列填空:
(1)寫出電解飽和食鹽水的離子方程式___。
(2)精制飽和食鹽水從圖中___位置補充,氫氧化鈉溶液從圖中___位置流出(選填“a”、“b”、“c”或“d”)。
(3)KClO3可以和草酸(H2C2O4)、硫酸反應生成高效的消毒殺菌劑ClO2,還生成CO2和KHSO4等物質。
寫出該反應的化學方程式___。
(4)室溫下,0.1mol/LNaClO溶液的pH___0.1mol/LNa2SO3溶液的pH(選填“大于”、“小于”或“等于”)。
(5)濃度均為0.1mol/L的Na2SO3和Na2CO3的混合溶液中,SO32-、CO32-、HSO3-、HCO3-濃度從大到小的順序為___。
已知:H2SO3:Ki1=1.54×102,Ki2=1.02×107,HClO:Ki1=2.95×108,H2CO3:Ki1=4.3×107,Ki2=5.6×1011。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】利用如圖裝置探究鐵在海水中的電化學防護,下列說法不正確的是

A.若X為鋅棒,開關K置于M處,可減緩鐵的腐蝕
B.若X為鋅棒,開關K置于M處,鐵電極的反應:Fe2e =Fe2+
C.若X為碳棒,開關K置于N處,可減緩鐵的腐蝕
D.若X為碳棒,開關K置于N處,鐵電極的反應:2H++2e=H2↑
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】依據氧化還原反應Zn(s)+Cu2+(aq)===Zn2+(aq)+Cu(s)設計的原電池如下圖所示。
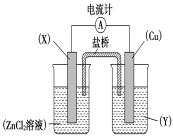
請回答下列問題:
(1)電極X的材料是____________;電解質溶液Y是__________________。
(2)銅電極為電池的________極,發生的電極反應為_______________________ X極上發生的電極反應為______________。
(3)外電路中的電子是從________極流向__________極(填名稱)。
(4)鹽橋中的Cl-向________極移動,如將鹽橋撤掉,電流計的指針將________偏轉。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】甲、乙兩個電解池均以Pt為電極,且互相串聯,甲池盛有AgNO3溶液,乙池中盛有一定量的某鹽溶液,通電一段時間后,測得甲池中某電極質量增加2.16 g,乙池中某電極上析出0.24 g金屬,則乙池中溶質可能是( )
A.KNO3B.MgSO4C.CuSO4D.Na2SO4
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com