
【題目】下列有關常溫下0.1 mol/L氨水(pH=11)的說法正確的是
A.該氨水顯弱堿性
B.加水稀釋過程中,![]() 的值減小
的值減小
C.與同溫下pH=11的NaOH溶液相比,NaOH溶液中c(Na+)大于氨水中c(NH4+)
D.加入少量NH4Cl 固體,溶液中水的電離平衡:H2O![]() H+ + OH―向右移動
H+ + OH―向右移動
 核心素養學練評系列答案
核心素養學練評系列答案科目:高中化學 來源: 題型:
【題目】合成氨工藝的一個重要工序是銅洗,其目的是用銅液[醋酸二氨合銅(I)、氨水]吸收在生產過程中產生的CO和CO2等氣體。銅液吸收CO的反應是放熱反應,其反應方程式為: Cu(NH3)2Ac+CO+NH3![]() [Cu(NH3)3CO]Ac
[Cu(NH3)3CO]Ac
完成下列填空:
(1)如果要提高上述反應的反應速率,可以采取的措施是_________。(選填編號)
a 減壓 b 增加NH3的濃度 c 升溫 d 及時移走產物
(2)銅液中的氨可吸收二氧化碳,寫出該反應的化學方程式__________
(3)銅液的組成元素中,短周期元素原子半徑從大到小的排列順序為_________。其中氮元素原子最外層電子排布的軌道表達式是___________。通過比較_____________可判斷氧,硫兩種非金屬元素的非金屬性強弱。
(4)已知CS2與CO2分子結構相似,CS2的電子式是________。CS2熔點高于CO2,其原因是 ______。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】工業上用鋁土礦(主要成分為Al2O3,含Fe2O3等雜質)為原料冶煉鋁的工藝如圖:
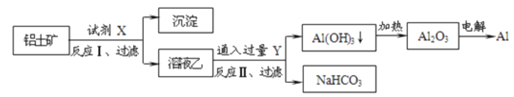
對上述流程判斷正確的是( )
A.試劑X為稀硫酸或氫氧化鈉溶液
B.反應II中生成Al(OH)3的反應為CO2+AlO2-+2H2O→Al(OH)3↓+HCO3-
C.結合質子(H+)的能力由強到弱的順序是AlO2->OH->CO32->HCO3-
D.Al2O3熔點很高,工業上還可采用點解熔融AlCl3冶煉Al
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】煙氣脫硝技術是煙氣治理的發展方向和研究熱點。
(1)用NH3選擇性脫除氮氧化物,有如下反應:
6NO(g)+4NH3(g)=5N2(g)+6H2O(g)
已知化學鍵的鍵能數據如下表:
化學鍵 | NO中的氮氧鍵 | N-H | N | O-H |
鍵能(kJ·mol-1) | a | b | c | d |
則該反應的ΔH=__kJ·mol-1。
(2)在汽車尾氣的凈化裝置中CO和NO發生反應:2NO(g)+2CO(g)![]() N2(g)+2CO(g) ΔH=-746.8kJ·mol-1。
N2(g)+2CO(g) ΔH=-746.8kJ·mol-1。
實驗測得:v正=k正·c2(NO)·c2(CO),v逆=k逆·c(N2)·c2(CO2)(k正、k逆為速率常數,只與溫度有關)
①達平衡后,僅升高溫度,k正增大的倍數__k逆增大的倍數(填“>”或“<”或“=”)。
②若在1L的密閉容器中充入1molCO和1molNO,在一定溫度下達到平衡,CO的轉化率為50%,則![]() =__。
=__。
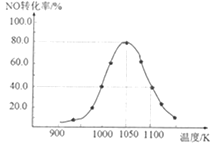
(3)現利用反應除去汽車尾氣中的NOx:C(s)+2NO(g)![]() N2(g)+CO2(g) ΔH=-34.0kJ·mol-1。在密閉容器中發生該反應,催化反應相同時間,測得不同溫度下NO的轉化率a(NO)隨溫度的變化如圖所示。由圖可知,1050K前反應中NO的轉化率隨溫度升高而增大,原因是__。
N2(g)+CO2(g) ΔH=-34.0kJ·mol-1。在密閉容器中發生該反應,催化反應相同時間,測得不同溫度下NO的轉化率a(NO)隨溫度的變化如圖所示。由圖可知,1050K前反應中NO的轉化率隨溫度升高而增大,原因是__。
(4)以連二硫酸根(S2O42-)為媒介,使用間接電化學法也可處理燃煤煙氣中的NO,裝置如圖所示:
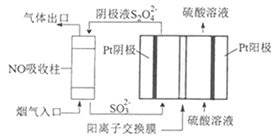
①陰極區的電極反應式為__。
②NO吸收轉化后的主要產物為NH4+,若通電時電路中轉移了0.3mole-,則此通電過程中理論上吸收的NO在標準狀況下的體積為__mL。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列關于元素金屬性、非金屬性的說法正確的是( )
A.![]() 的酸性強于
的酸性強于![]() ,故非金屬性:
,故非金屬性:![]()
B.第ⅠA族金屬元素是同周期中金屬性最強的元素
C.僅用![]() 溶液、
溶液、![]() 溶液、
溶液、![]() 溶液,無法驗證
溶液,無法驗證![]() 、
、![]() 的金屬性強弱
的金屬性強弱
D.第ⅦA族元素的陰離子還原性越強,其最高價氧化物對應水化物的酸性越強
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】鋰因其重要的用途,被譽為“能源金屬”和“推動世界前進的金屬”.
(1)Li3N可由Li在N2中燃燒制得.取4.164g 鋰在N2中燃燒,理論上生成Li3N__g;因部分金屬Li沒有反應,實際反應后固體質量變為6.840g,則固體中Li3N的質量是__g(保留三位小數,Li3N的式量:34.82)
(2)已知:Li3N+3H2O→3LiOH+NH3↑.取17.41g純凈Li3N,加入100g水,充分攪拌,完全反應后,冷卻到20℃,產生的NH3折算成標準狀況下的體積是__L.過濾沉淀、洗滌、晾干,得到LiOH固體26.56g,計算20℃時LiOH的溶解度__.(保留1位小數,LiOH的式量:23.94)
鋰離子電池中常用的LiCoO2,工業上可由碳酸鋰與堿式碳酸鈷制備.
(3)將含0.5molCoCl2的溶液與含0.5molNa2CO3的溶液混合,充分反應后得到堿式碳酸鈷沉淀53.50g;過濾,向濾液中加入足量HNO3酸化的AgNO3溶液,得到白色沉淀143.50g,經測定溶液中的陽離子只有Na+,且Na+有1mol;反應中產生的氣體被足量NaOH溶液完全吸收,使NaOH溶液增重13.20g,通過計算確定該堿式碳酸鈷的化學式__,寫出制備堿式碳酸鈷反應的化學方程式__.
(4)Co2(OH)2CO3和Li2CO3在空氣中保持溫度為600~800℃,可制得LiCoO2,已知: 3Co2(OH)2CO3+O2→2Co3O4+3H2O+3CO2;4Co3O4+6Li2CO3+O2→12LiCoO2+6CO2
按鈷和鋰的原子比1:1混合固體,空氣過量70%,800℃時充分反應,計算產物氣體中CO2的體積分數__.(保留三位小數,已知空氣組成:N2體積分數0.79,O2體積分數0.21)
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】不同元素的原子吸引電子的能力大小可用一定數值X表示,X值越大,其原子吸引電子的能力越強,在所形成的化合物中為帶負電荷的一方。下表是某些元素的X值:
元素符號 |
|
|
|
|
|
|
X值 | 0.98 | 1.57 | 2.04 | 2.55 | 3.44 | 3.98 |
元素符號 |
|
|
|
|
|
|
X值 | 0.93 | 1.60 | 1.90 | 2.19 | 2.55 | 3.16 |
(1)通過分析X值的變化規律,確定![]() 、
、![]() 的X值范圍:______
的X值范圍:______![]() ______;______
______;______![]() ______。
______。
(2)推測X值與原子半徑的關系為______。
(3)某有機化合物的結構為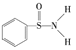 ,其中
,其中![]() 鍵中,你認為共用電子對偏向______(填元素符號)。
鍵中,你認為共用電子對偏向______(填元素符號)。
(4)如果X值為電負性的數值,試推斷![]() 中化學鍵的類型為______。
中化學鍵的類型為______。
(5)預測元素周期表中X值最小的元素(放射性元素除外)是______(填元素符號)。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列敘述正確的是
A.在醋酸溶液的![]() ,將此溶液稀釋1倍后,溶液的
,將此溶液稀釋1倍后,溶液的![]() ,則
,則![]()
B.在滴有酚酞溶液的氨水里,加入![]() 至溶液恰好無色,則此時溶液的
至溶液恰好無色,則此時溶液的![]()
C.![]() 鹽酸的
鹽酸的![]() ,
,![]() 鹽酸的
鹽酸的![]()
D.若1mL![]() 的鹽酸與100mL
的鹽酸與100mL![]() 溶液混合后,溶液的
溶液混合后,溶液的![]() 則
則![]() 溶液的
溶液的![]()
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com