
【題目】已知鋅與稀鹽酸反應放熱,某學生為了探究反應過程中的速率變化,用排水集氣法收集反應放出的氫氣。所用稀鹽酸濃度有1.00 mol·L-1、2.00 mol·L-1兩種濃度,每次實驗稀鹽酸的用量為25.00 mL,鋅有細顆粒與粗顆粒兩種規(guī)格,用量為6.50 g。實驗溫度為298 K、308 K。
(1)完成以下實驗設計(填寫表格中空白項),并在實驗目的一欄中填出對應的實驗編號:
編號 | T/K | 鋅規(guī)格 | 鹽酸濃度/mol·L-1 | 實驗目的 |
① | 298 | 粗顆粒 | 2.00 | (Ⅰ)實驗①和②探究鹽酸濃度對該反應速率的影響; (Ⅱ)實驗①和_______探究溫度對該反應速率的影響; (Ⅲ)實驗①和______探究鋅規(guī)格(粗、細)對該反應速率的影響。 |
② | 298 | 粗顆粒 | 1.00 | |
③ | 308 | 粗顆粒 | 2.00 | |
④ | 298 | 細顆粒 | 2.00 |
(2)實驗①記錄如下(換算成標況):
時間(s) | 10 | 20 | 30 | 40 | 50 | 60 | 70 | 80 | 90 | span>100 |
氫氣體積 (mL) | 16.8 | 39.2 | 67.2 | 224 | 420 | 492.8 | 520.8 | 543.2 | 554.4 | 560 |
①計算在30s~40s范圍內鹽酸的平均反應速率ν(HCl)=________(忽略溶液體積變化)。
②反應速率最大的時間段(如0s~10s......)為_______,可能原因是______。
③反應速率最小的時間段為________,可能原因是_________________________________。
(3)另一學生也做同樣的實驗,由于反應太快,測量氫氣的體積時不好控制,他就事先在鹽酸溶液中分別加入等體積的下列溶液以減慢反應速率,在不影響產生H2氣體總量的情況下,你認為他上述做法中可行的是____________(填相應字母);
A.氨水 B.CuCl2溶液 C.NaCl溶液 D.KNO3溶液
(4)另有某溫度時,在2L容器中X、Y、Z物質的量隨時間的變化關系曲線如下圖所示,該反應的化學方程式為:_____________________________。
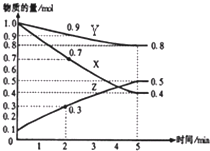
【答案】③ ④ 0.056 mol·L-1·s-1 40s~50s 反應放熱 90s~100s 鹽酸濃度降低 C 3X+Y![]() 2Z
2Z
【解析】
(1)根據(jù)實驗的目的和影響化學反應速率的因素來設計實驗,注意對照實驗的設計關鍵是采用控制變量法來比較外界條件對反應速率的影響;
(2)①計算氫氣的物質的量n(H2),再計算出溶液中氫離子濃度的改變,根據(jù)v=△c÷△t計算30s~40s范圍內鹽酸的平均反應速率;
②③根據(jù)相等時間段內,產生的氫氣的體積越大,可以確定反應速率越快,據(jù)影響反應速率的因素來判斷;
(3)根據(jù)濃度以及原電池原理的應用來確定化學反應速率的變化情況。據(jù)此解答。
(4)根據(jù)圖像分析反應物和生成物,結合變化量之比是化學計量數(shù)之比解答。
(1)由實驗目的可以知道,探究濃度、溫度、接觸面積對化學反應速率的影響,實驗①②探究鹽酸濃度對該反應速率的影響。要探究溫度對該反應速率的影響,則固體的表面積以及鹽酸的濃度應該是一樣的,而兩實驗的溫度應控制不同,所以實驗①和③可達到實驗目的。探究鋅規(guī)格(粗、細)對該反應速率的影響,要求實驗溫度以及鹽酸的濃度是相等的,表面積不同,所以實驗①和④可達到實驗目的。
(2)①在30s~40s范圍內氫氣的n(H2)=(224-67.2)×10-3L÷22.4L/mol=0.007mol,則溶液中的氫離子改變了0.007mol×2=0.014mol,則△c(H+)=0.014mol÷0.025L=0.56mol/L,所以在30s~40s范圍內鹽酸的平均反應速率v(HCl)=0.56mol/L÷10s=0.056mol/(L·s)。
②根據(jù)相等時間段內,產生的氫氣的體積越大,可以確定反應速率越快,所以反應速率最大的時間段是40s~50s,可能原因是反應放熱,溫度高,反應速率快。
③根據(jù)相等時間段內,產生的氫氣的體積越小,可以確定反應速率越慢,所以反應速率最小的時間段是90s100s,可能原因是反應進行過程中,鹽酸濃度減小,反應速率變慢。
(3)A.加入氨水,鹽酸被中和,能達到減慢速率的目的,但是影響了氫氣的產量,故A不符合要求;
B.加入氯化銅,則金屬鋅會置換出金屬銅,形成Cu、Zn、鹽酸原電池,會加快反應速率,故B不符合要求;
C.在鹽酸中加入NaCl溶液相當于將鹽酸稀釋,鹽酸中氫離子濃度減小,所以速率減慢,但不影響氫氣的產量,故C符合要求;
D.加入硝酸鉀溶液后,鋅與氫離子、硝酸根發(fā)生氧化還原反應生成一氧化氮,不再產生氫氣,故D不符合要求。
答案選C。
(4)根據(jù)圖像可知X和Y的物質的量減少,是反應物,Z是生成物,達到平衡時X減少1.0mol-0.4mol=0.6mol,Y減少1.0mol-0.8mol=0.2mol,Z增加了0.5mol-0.1mol=0.4mol,所以X、Y、Z物質的物質的量之比是3:1:2,因此方程式為3X+Y![]() 2Z。
2Z。


 名師指導期末沖刺卷系列答案
名師指導期末沖刺卷系列答案科目:高中化學 來源: 題型:
【題目】淀粉在一定條件下水解可生成A,氣態(tài)烴C中碳元素與氫元素的質量比為12︰1,F(xiàn)分子式為C4H6O2,具有香味、難溶于水的油狀液體,G可作高分子涂料。有關物質的轉化關系如下圖:

請回答:
(1)物質B中所含的官能團名稱是____。
(2)寫出反應④的化學方程式_____。
(3)下列有關說法中正確的是____。
A.物質A的分子式為C6H12O6
B.物質 B、E可用飽和碳酸鈉溶液進行鑒別
C.物質C、F均能使酸性高錳酸鉀溶液褪色
D.物質G的鏈節(jié)為![]()
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】一定溫度下,一定體積的容器中發(fā)生反應:A(s)+3B(g)![]() 2C(g)+2D(g),下列描述中能說明該反應達到平衡的是
2C(g)+2D(g),下列描述中能說明該反應達到平衡的是
①A的質量不發(fā)生變化 ②單位時間內生成a mol A,同時消耗2a mol C
③容器中的壓強不再變化 ④混合氣體的密度不再變化
⑤n(A):n(B):n(C):n(D)=1:3:2:2 ⑥B的濃度不變
A. ②③⑤⑥ B. ①③④⑥ C. ②④⑤ D. ②③④
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】(題文)在容積為1.00L的容器中,通入一定量的N2O4,發(fā)生反應N2O4(g)2NO2(g),隨溫度的升高,混合氣體的顏色變深。回答下列問題:
(1)反應的△H_____0(填“大于”或“小于”);100℃時,體系中各物質濃度隨時間變化如圖所示。在0~60s時段,反應速率v(N2O4)為_____molL﹣1s﹣1。
(2)100℃時達平衡后,改變反應溫度為T,c(N2O4)以0.0020molL﹣1s﹣1的平均速率降低,經(jīng)10s又達到平衡。T_____100℃(填“大于”或“小于”),判斷理由是_____________。

(3)溫度T時反應達平衡后,將反應容器的容積減少一半,平衡向_____(填“正反應”或“逆反應”)方向移動。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】中國政府承諾,到2020年,單位GDP二氧化碳排放比2005年下降40%~50%。CO2可轉化成有機物實現(xiàn)碳循環(huán)。在體積為1L的密閉容器中,充入 1mol CO2和3mol H2,一定條件下反應:CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g),測得CO2和CH3OH(g)的濃度隨時間變化如下圖所示。
CH3OH(g)+H2O(g),測得CO2和CH3OH(g)的濃度隨時間變化如下圖所示。
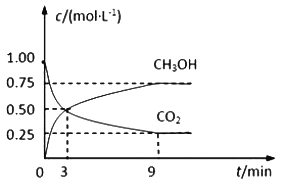
(1)從3 min到9 min,υ(H2)=________mol·L-1·min-1。
(2)能說明上述反應達到平衡狀態(tài)的是____________(填編號)。
A.反應中CO2與CH3OH的物質的量濃度之比為1∶1(即圖中交叉點)
B.混合氣體的密度不隨時間的變化而變化
C.單位時間內消耗3mol H2,同時生成1mol H2O
D.CO2的體積分數(shù)在混合氣體中保持不變
(3)平衡時CO2的轉化率為______________。
(4)平衡時混合氣體中CH3OH(g)的體積分數(shù)是__________________。
(5)一定溫度下,第9分鐘時υ逆(CH3OH) _______(填“大于”、“小于”或“等于”)第3分鐘時υ正(CH3OH)。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】有關物質的轉化關系如下圖所示(部分生成物與反應條件已略去)。其中A是最常見的無色液體,B、C、D、E均為單質,G是一種極易溶于水的堿性氣體,F(xiàn)是胃酸的主要成分,K是不溶于稀硝酸的白色沉淀,反應4是工業(yè)制X的主要反應之一。

(1)G的電子式為_____________。
(2)I的化學式為____________。
(3)寫出反應2的離子方程式________________________________________。
(4)寫出反應4的化學方程式________________________________________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】中科院深圳先進技術研究院成功研發(fā)了一種高效低成本儲能電池——“鋁一石墨”雙離子電池,電池總反應為Al+xC+Li++PF6 -![]() AlLi+Cx PF6下列有關該電池的說法正確的是
AlLi+Cx PF6下列有關該電池的說法正確的是
A. 放電時,PF6-向正極移動
B. 放電時,負極反應為A1-3e-====Al3+
C. 充電時,兩個電極增加的質量相等
D. 充電時,陽極反應為xC+PF6--e-==CxPF6
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】立方烷(C8H8)其八個碳原子對稱地排列在立方體的八個角上。以下相關說法錯誤的是

A. 立方烷在空氣中可燃,燃燒有黑煙產生
B. 立方烷一氯代物1種、二氯代物有3種
C. 立方烷是苯(C6H6)的同系物,也是苯乙烯(C6H5-CH=CH2)的同分異構體
D. 八硝基立方烷完全分解可能只產生二氧化碳和氮氣
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】某反應由兩步反應A![]() B
B![]() C構成,反應過程中的能量變化曲線如圖(E1、E3表示兩反應的活化能)。下列有關敘述正確的是
C構成,反應過程中的能量變化曲線如圖(E1、E3表示兩反應的活化能)。下列有關敘述正確的是

A. 三種化合物的穩(wěn)定性順序:B﹤A﹤C
B. 兩步反應均為放熱反應
C. 加入催化劑不改變反應的焓變,但能提高產率
D. 整個反應的ΔH=E1-E2
查看答案和解析>>
國際學校優(yōu)選 - 練習冊列表 - 試題列表
湖北省互聯(lián)網(wǎng)違法和不良信息舉報平臺 | 網(wǎng)上有害信息舉報專區(qū) | 電信詐騙舉報專區(qū) | 涉歷史虛無主義有害信息舉報專區(qū) | 涉企侵權舉報專區(qū)
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com