
【題目】某含鉻(Cr2O![]() )廢水用硫酸亞鐵銨[FeSO4·(NH4)2SO4·6H2O]處理,反應中鐵元素和鉻元素完全轉化為沉淀。該沉淀經干燥后得到n mol FeO·FeyCrxO3,不考慮處理過程中的實際損耗,下列敘述錯誤的是( )
)廢水用硫酸亞鐵銨[FeSO4·(NH4)2SO4·6H2O]處理,反應中鐵元素和鉻元素完全轉化為沉淀。該沉淀經干燥后得到n mol FeO·FeyCrxO3,不考慮處理過程中的實際損耗,下列敘述錯誤的是( )
A. 消耗硫酸亞鐵銨的物質的量為n(2-x)mol
B. 處理廢水中Cr2O![]() 的物質的量為
的物質的量為![]() mol
mol
C. 反應中發生轉移的電子總物質的量為3nxmol
D. 在FeO·FeyCrxO3中,3x=y
科目:高中化學 來源: 題型:
【題目】下列關于堿金屬的敘述中,正確的是
A. 金屬鈉著火時,可用水或泡沫滅火器滅火
B. 堿金屬單質都可保存在煤油中
C. 鈉離子核外電子數比鈉原子核外電子數少
D. 堿金屬中密度最小、熔沸點最高的是銫
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】(1)與16g氧氣所含原子總數相同的氨氣是_____________g;在相同條件下,在5.6g氮氣中應添加___________g氨氣所組成的混合氣體與16g氧氣所占的體積相等。
(2)把__________g NaOH溶解在90g水中,才能使得每10個水分子中有1個Na+。
(3)質量之比為16∶7∶6的三種氣體SO2、CO、NO,氧原子個數之比為________。
(4)某氣體氧化物的化學式為RO2,在標準狀況下,0.92g該氧化物的體積為448mL,則該氧化物的摩爾質量為________。
(5)8.5g氫氧根離子含有的電子數目為_____________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】用98%的濃H2SO4(密度為1.84 g/mL)配制1 mol·L-1的稀H2SO4100mL,配制過程中可能用到下列儀器:
①100mL量筒;②10mL量筒;③50mL燒杯;④托盤天平;⑤100mL容量瓶;⑥膠頭滴管;⑦玻璃棒。按使用出現的先后順序排列正確的是
A. ②⑥③⑦⑤ B. ④③⑤⑦⑥ C. ①③⑦⑤⑥ D. ②⑤⑦⑥
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】《本草衍義》中對精制砒霜有如下敘述:“取砒之法,將生砒就置火上,以器覆之,令砒煙上飛著覆器,遂凝結累然下垂如乳,尖長者為勝,平短者次之。”文中涉及的操作方法是
A. 蒸餾 B. 萃取 C. 升華 D. 結晶
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】CO2經催化加氫可合成乙烯:2CO2 (g) +6H2 (g) ![]() C2H4(g)+4H2O(g)。0.1 MPa時,按n(CO2):n(H2)=l:3投料,測得不同溫度下平衡時體系中各物質濃度的關系如圖。下列敘述不正確的是
C2H4(g)+4H2O(g)。0.1 MPa時,按n(CO2):n(H2)=l:3投料,測得不同溫度下平衡時體系中各物質濃度的關系如圖。下列敘述不正確的是

A. 該反應的△H<0
B. 曲線b代表H2O
C. N點和M點所處狀態的c(H2)不一樣
D. 其它條件不變,T1℃、0.2 MPa下反應達平衡時c(H2)比M點大
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】美、英研究人員相繼宣布“去除排斥基因”的豬已經降生。人們可以利用這種豬大量“生產”適用于移植手術的器官。在此之前如果把豬器官移植給人體,人體的免疫系統能識別豬細胞上的X物質,從而發生強烈的排異反應,X物質所處的位置和化學成分分別是( )
A. 細胞膜類脂 B. 細胞膜糖與蛋白質的復合物
C. 細胞核脫氧核糖核酸 D. 細胞質蛋白質
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】運用化學反應原理研究化學反應有重要意義。
(1)硫酸生產中,SO2催化氧化生成SO3:2SO2(g)+O2(g)![]() 2SO3(g),混合體系中SO3的百分含量和溫度的關系如圖1所示(曲線上任何一點都表示平衡狀態)。
2SO3(g),混合體系中SO3的百分含量和溫度的關系如圖1所示(曲線上任何一點都表示平衡狀態)。
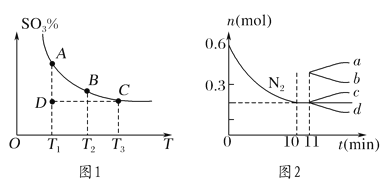
①若在恒溫、恒壓條件下向上述平衡體系中通入氦氣,平衡________(填“向左”“向右”或“不”)移動。
②若反應進行到狀態D時,v正________(填“>”“<”或“=”)v逆。
(2)課本里介紹的合成氨技術叫哈伯法:N2(g)+3H2(g)![]() 2NH3(g) ΔH<0,應用此法反應達到平衡時反應物的轉化率不高。
2NH3(g) ΔH<0,應用此法反應達到平衡時反應物的轉化率不高。
①能使該反應的反應速率增大,且平衡向正反應方向移動的措施是________(填編號)。
A.使用更高效的催化劑
B.升高溫度
C.及時分離出氨氣
D.充入氮氣,增大氮氣的濃度(保持容器體積不變)
②若在某溫度下,2 L的密閉容器中發生合成氨的反應,圖2表示N2的物質的量隨時間的變化曲線。用H2表示0~10 min內該反應的平均速率v(H2)=________。從第11 min起,壓縮容器的體積為1 L,則n(N2)的變化曲線為________(填編號)。
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com