
【題目】下列說法不正確的是

A. 反應物分子(或離子)間的每次碰撞是反應的先決條件
B. 反應物的分子的每次碰撞都能發生化學反應
C. 活化分子具有比普通分子更高的能量
D. 活化能是活化分子的能量與分子平均能量之差,如圖所示正反應的活化能為E-E1
科目:高中化學 來源: 題型:
【題目】在一定溫度下,醋酸溶液中存在電離平衡:CH3COOH![]() CH3COO- + H+
CH3COO- + H+
(1)某溫度時,0.1 mol·L-1的醋酸溶液中的c(H+) 與0.01 mol·L-1的醋酸溶液中的c(H+)的比值______(填“大于”“小于”或“等于”)10。
(2)已知:25 ℃時,該電離平衡的平衡常數為1.75×10-5。
①求該溫度時,a mol·L-1的醋酸溶液中c1(H+)=________________mol·L-1 (用含a的代數式表示)。[提示:此時電離度比較小,進行簡化計算,平衡時c(CH3COOH)可用初始濃度代替,水電離出的c(H+)、c(OH-)忽略不計,下同]
②若該溫度時向該溶液中加入一定量的CH3COONH4(假設溶液體積不變),使溶液中c(CH3COO-)為b mol·L-1,則此時c2(H+)=____________________mol·L-1(用含a、b的代數式表示)。
③c1(H+)________(填“大于”“小于”或“等于”)c2(H+)。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】對一定量氣體體積的探究。
已知1 mol不同氣體在不同條件下的體積:
化學式 | 條件 | 1 mol氣體體積/L |
H2 | 0 ℃,101 kPa | 22.4 |
O2 | 0 ℃,101 kPa | 22.4 |
CO | 0 ℃,101 kPa | 22.4 |
H2 | 0 ℃,202 kPa | 11.2 |
CO2 | 0 ℃,202 kPa | 11.2 |
N2 | 273 ℃,202 kPa | 22.4 |
NH3 | 273 ℃,202 kPa | 22.4 |
(1)從上表分析得出的結論:
①1 mol任何氣體,在標準狀況下的體積都約為________。
②1 mol不同的氣體,在不同的條件下,體積________(填“一定”“一定不”或“不一定”)相等。
(2)理論依據:相同條件下,1 mol任何氣體的體積幾乎相等,原因是:
①________________________________________________________________________,
②________________________________________________________________________。
(3)應用:在標準狀況下,4 g O2的體積為多少升?(寫出計算過程)___________________________________________________________________________
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】NiSO4·6H2O是一種綠色易溶于水的晶體,廣泛用于化學鍍鎳、生產電池等。可由電鍍廢渣(除含鎳外,還含有Cu、Zn、Fe、Cr等雜質)為原料獲得。工藝流程如下圖:
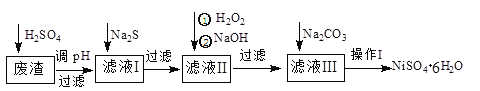
請回答下列問題:
(1)用稀硫酸溶解廢渣時,為了提高浸取率可采取的措施有_________________(任寫一點)。
(2)向濾液中滴入適量的Na2S溶液,目的是除去Cu2+、Zn2+,寫出除去Cu2+的離子方程式:____________________________________________。
(3)在40℃左右,用6%的H2O2氧化Fe2+,再在95℃時加入NaOH調節pH,除去鐵和鉻。此外,還常用NaClO3作氧化劑,在較小的pH條件下水解,最終生成一種淺黃色的黃鐵礬鈉[Na2Fe6(SO4)4(OH)12]沉淀除去。如圖是溫度—pH與生成的沉淀關系圖,圖中陰影部分是黃鐵礬穩定存在的區域[已知25℃時,Fe(OH)3的Ksp=2.64×10-39]。
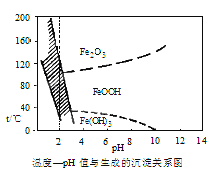
下列說法正確的是(選填序號)_______。
a. FeOOH中鐵為+2價
b.若在25℃時,用H2O2氧化Fe2+,再在pH=4時除去鐵,此時溶液中c(Fe3+)=2.6×10-29mol·L-1
c.用氯酸鈉在酸性條件下氧化Fe2+的離子方程式為6Fe2++C1O3-+6H+=6Fe3++C1-+3H2O
d.工業生產中常保持在85~95℃生成黃鐵釩鈉,此時水體的pH約為3
(4)上述流程中濾液I的主要成分是___________。
(5)操作I的實驗步驟依次為(實驗中可選用的試劑:6mol·L-1的H2SO4溶液、蒸餾水、pH試紙):
①___________;②___________;③蒸發濃縮、冷卻結晶,過濾得NiSO4·6H2O晶體:④用少量乙醇洗滌NiSO4·6H2O晶體并晾干。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列說法中不正確的是( )
A. 一定條件下SiO2可與堿和氫氟酸反應,故其屬于兩性氧化物
B. 制玻璃、水泥的原料都用到石灰石
C. 硅在常溫下不與氧氣、氯氣、硝酸反應
D. 沙子、石英、水晶的主要成分都是SiO2。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】分別調節0.01mol·L-1HCOOH溶液、0.01mol·L-1氨水的pH,系統中微粒濃度的負對數值(-lgc)與pH的關系分別如下圖所
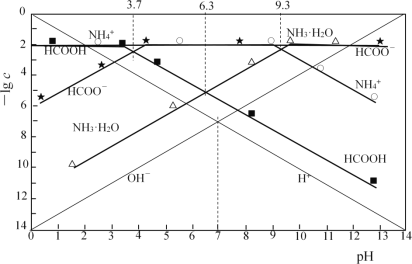
下列說法錯誤的是
A. 25℃時,NH3·H2O![]() NH4++OH-的lgK=-4.7
NH4++OH-的lgK=-4.7
B. 25℃時,0.01mol·L-1HCOOH溶液的pH為3.7
C. HCOONa溶液中加入NH4Cl至溶液呈中性:c(Cl-)>c(Na+)>c(HCOO-)
D. HCOONa溶液中加入KHSO3至溶液呈中性:c(HCOOH) +c(H2SO3) = c(SO32-)
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】NaH2PO2(次磷酸鈉)易溶于水,水溶液近中性,具有強還原性,可用于化學鍍銀、鎳、鉻等。一種利用泥磷(含P4和少量CaO、Fe2O3、Al2O3、CaCl2等)為原料制備NaH2PO2·H2O的工藝流程如下:
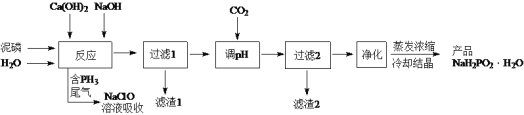
已知P4與兩種堿的反應主要有:
Ⅰ. 2Ca(OH)2+P4+4H2O=2Ca(H2PO2)2+2H2↑
Ⅱ. 4NaOH + P4+8H2O = 4NaH2PO2·H2O+2H2↑
Ⅲ. 4NaOH + P4+2H2O = 2Na2HPO3 +2PH3↑
Ⅳ. NaH2PO2+NaOH = Na2HPO3+H2↑
(1)尾氣中的PH3被NaClO溶液吸收生成NaH2PO2和NaCl的離子方程式為_____。
(2)“反應”在溫度和水量一定時,混合堿總物質的量與P4的物質的量之比[n(堿)/ n(磷)]與NaH2PO2產率的關系如圖所示。當n(堿)/ n(磷)>2.6時,NaH2PO2的產率隨n(堿)/ n(磷)的增大而降低的可能原因是_____。

(3)通CO2“調pH”至溶液的pH約為_____,濾渣2主要成分為_____(填化學式)。
(4)“過濾2”的濾液須用Ag2SO4、Ba(OH) 2及Na2S溶液除去其中Cl-及Fe2+等,其中加入的Ag2SO4溶液不宜過量太多,其主要原因是_____。
(5)用NiCl2、NaH2PO2溶液化學鍍Ni,同時生成H3PO4和氯化物的化學方程式為_____。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】高鐵酸鹽等具有強氧化性,溶液pH越小氧化性越強,可用于除去廢水中的氨氮、重金屬等。
(1)用Na2O2與FeSO4干法制備Na2FeO4的反應歷程中包含的熱化學方程式有:
2FeSO4(s)+ Na2O2(s) = Fe2O3(s)+Na2SO4(s)+SO3(g) ![]() H1=akJ·mol-1
H1=akJ·mol-1
2 Fe2O3(s)+2 Na2O2(s) =4NaFeO2(s)+ O2(g) ![]() H2=bkJ·mol-1
H2=bkJ·mol-1
2SO3(g) +2Na2O2(s) =2Na2SO4(s)+ O2(g) ![]() H3=ckJ·mol-1
H3=ckJ·mol-1
2NaFeO2(s)+3Na2O2(s) =2Na2FeO4(s)+2Na2O(s) ![]() H4=dkJ·mol-1
H4=dkJ·mol-1
則反應2FeSO4(s) + 6Na2O2(s) =2Na2FeO4(s)+2Na2O(s)+2Na2SO4(s) + O2(g)的![]() H=_____kJ·mol-1(用含a、b、c、d的代數式表示);該反應中,每生成1mol Na2FeO4轉移電子數為_____mol。
H=_____kJ·mol-1(用含a、b、c、d的代數式表示);該反應中,每生成1mol Na2FeO4轉移電子數為_____mol。
(2)J.C.Poggendor早在1841年利用純鐵作電極插入濃的NaOH溶液電解制得Na2FeO4,陽極生成FeO42-的電極反應式為_____;Deinimger等對其進行改進,在陰、陽電極間設置陽離子交換膜,有效提高了產率,陽離子交換膜的作用是_____。
(3)K2FeO4的穩定性與pH關系如圖-1所示,用K2FeO4去除某氨氮(NH3-N)廢水,氨氮去除率與pH關系如圖-2;用K2FeO4處理Zn2+濃度為0.12mg·L—1的含鋅廢水{Ksp[Zn(OH)2]=1.2×10-17},鋅殘留量與pH關系如圖-3所示(已知:K2FeO4與H2O反應生成Fe(OH)3的過程中,可以捕集某些難溶金屬的氫氧化物形成共沉淀)。
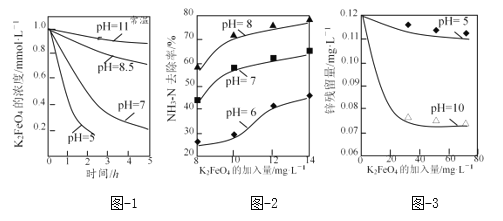
①pH=11時,K2FeO4與H2O反應生成Fe(OH)3和O2等物質的離子方程式為_____。
②圖-2中:pH越大氨氮的去除率也越大,其原因可能是_____。
③圖-3中:pH=10時鋅的去除率比pH=5時大得多,其原因是_____(從鋅的存在形態的角度說明)。
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com