
【題目】將NaCl和CuSO4兩種溶液等體積混合后用石墨電極進行電解,電解過程中,溶液pH隨時間t變化的曲線如圖所示,則下列說法正確的是

A.整個過程中兩電極反應2Cl--2e-=Cl2↑、2H+2e-=H2↑不可能同時發生
B.電解至C點時,往電解質溶液中加入適量CuCl2固體,即可使電解質溶液恢復至原來的濃度
C.AB段表示電解過程中H+被還原,pH增大
D.原混合溶液中NaCl和CuSO4濃度之比恰好為2:1
【答案】A
【解析】
KCl和CuSO4兩種溶液等體積混合后,用石墨電極進行電解,電解分3個階段:
[第一階段]相當于電解氯化銅,陽極:氯離子失電子,陰極:銅離子得電子,因為銅離子水解使溶液顯酸性,隨著電解的進行,銅離子的濃度降低,酸性減弱,pH將增大;
[第二階段]陽極:氫氧根離子失電子(來源于水的電離),陰極:仍然為銅離子得電子,因為氫氧根離子消耗,使水溶液中氫離子濃度增大,pH迅速減小;
[第三階段]陽極:氫氧根離子失電子,陰極:氫離子得電子,它們都來源于水的電離,實質是電解水,導致溶液的體積減小,使溶液中氫離子濃度增大,pH繼續減小,以此解答本題。
A.根據以上分析,氯離子反應完,銅離子還剩,所以整個過程中兩電極反應:2Cl2e═Cl2↑,2H++2e═H2↑不可能同時出現,故A正確;
B.根據以上分析,電解至C點時,在電解液中應加入CuCl2固體和CuO固體,故B錯誤;
C.根據以上分析,因為銅離子水解使溶液顯酸性,隨著電解的進行,銅離子的濃度降低,酸性減弱,pH將增大,故C錯誤;
D.因為由第二階段陽極氫氧根離子失電子的同時,陰極仍然為銅離子得電子,所以原混合溶液中KCl和CuSO4的濃度之比不是2:1,故D錯誤;
故答案為:A。


科目:高中化學 來源: 題型:
【題目】亮菌甲素(圖 a) 用于急性膽囊炎、慢性膽囊炎發作、其他膽道疾病并發急性感染及慢性淺表性胃炎、萎縮性胃炎, 配以輔料丙二醇溶成針劑用于臨床。若使用廉價的二甘醇(圖 b) 作為輔料, 會使人中毒。下列說法正確的是
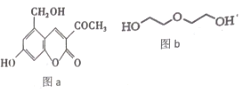
A.l mol 亮菌甲素與溴水混合,最多消耗Br2 4 mol
B.亮菌甲素中所有的碳原子不可能共平面
C.l mol 亮菌甲素反應最多消耗 5molH2或2molNaOH
D.等物質的量的丙二醇和二甘醇充分燃燒消耗的氧氣量不相同
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】酸性鋅錳干電池是一種一次性電池,外殼為金屬鋅,中間是碳棒,其周圍是由碳粉、MnO2、ZnCl2和NH4Cl等組成的糊狀填充物。該電池放電過程產生MnOOH。回收處理該廢電池可得到多種化工原料。有關數據如下表所示:
化合物 | Zn(OH)2 | Fe(OH)2 | Fe(OH)3 |
Ksp近似值 | 10-17 | 10-17 | 10-39 |
(1)Fe(OH)3沉淀溶解平衡常數(Ksp)的表達式是什么?__________________。
(2)Fe(OH)3能否溶于稀硫酸?________。試用沉淀溶解平衡理論解釋。____________。
(3)常溫下,若使FeCl3溶液中的Fe3+沉淀完全,需加入NaOH溶液調整溶液的pH為多少?(離子濃度小于1×10-5 mol·L-1時,即可認為該離子沉淀完全)_____________。
(4)向等物質的量濃度的Zn2+、Fe3+的混合溶液中逐滴加入NaOH溶液,最先產生的沉淀是什么?_____________。
(5)若在ZnCl2溶液中混有少量的Fe2+,應如何除去?_________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】辣椒的味道主要來自辣椒素類化合物。一種合成辣椒素中間體![]()
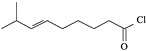
![]() 的合成路線如下:
的合成路線如下:
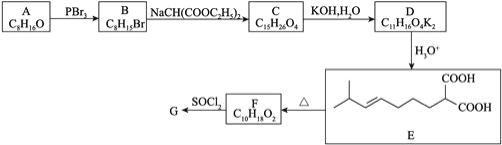
回答下列問題:
![]() 中所含官能團的名稱為_____________。
中所含官能團的名稱為_____________。
![]() 的結構簡式為______________________。
的結構簡式為______________________。
![]() 、
、![]() 的反應類型分別是______________、______________。
的反應類型分別是______________、______________。
![]() 的化學方程式為___________________________。
的化學方程式為___________________________。
![]() 滿足下列條件的E的同分異構體有________種
滿足下列條件的E的同分異構體有________種![]() 不考慮立體異構
不考慮立體異構![]() 。
。
![]() 含有一個六元碳環
含有一個六元碳環![]() 環上三個碳原子分別連有一個取代基且其中兩個為羧基。其中核磁共振氫譜有7組峰的結構簡式為______________。
環上三個碳原子分別連有一個取代基且其中兩個為羧基。其中核磁共振氫譜有7組峰的結構簡式為______________。
![]() 參照上述合成路線,以1,
參照上述合成路線,以1,![]() 丁二烯和
丁二烯和![]() 為原料
為原料![]() 無機試劑任選
無機試劑任選![]() ,設計制備
,設計制備 的合成路線_______________。
的合成路線_______________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】第VA族元素在生產、生活中有重要用途。回答下列問題:
(1)三聚磷酸鈉(俗稱“五鈉”常用于食品生產中,作水分保持劑、品質改良劑等。
①磷酸的結構式如圖所示,其主要的電離方程式為______________。
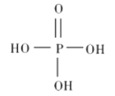
②三聚磷酸是三分子磷酸脫去兩分子水后的產物,三聚磷酸鈉的化學式為_______________。
(2)在堿性條件下,次磷酸鹽(H2PO2-)可用于化學鍍銀,寫出其反應的離子方程式______________。(氧化產物與還原產物物質的量之比為1:4)
(3)由工業白磷(含少量砷、鐵、鎂等)制備高純白磷(熔點44℃,沸點280℃),主要生產流程如下:
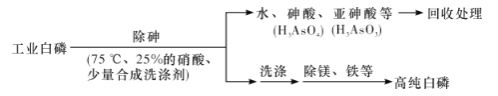
①除砷過程在75 ℃下進行,其合理的原因是____________(填字母代號)。
a,使白磷熔化,并溶于水 b.降低白磷的毒性
c.溫度不宜過高,防止硝酸分解 d.適當提高溫度,增大反應速率
②硝酸氧化除砷時被還原為NO,寫出砷轉化為亞砷酸的化學方程式:______________________________。
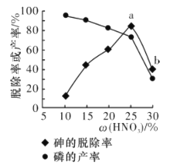
③某條件下,用一定量的硝酸處理一定量的工業白磷,砷的脫除率及磷的產率隨硝酸質量分數的變化如圖所示,砷的脫除率從a點到b點降低的原因是__________________。
(4)常溫下銀氨溶液中存在平衡:Ag+(aq) + 2NH3(aq) ![]() Ag(NH3)2+(aq),K=l.10×107 ;已知常溫下Ksp(AgCl)=1.45×10-10計算可逆反應AgCl(s) +2NH3(aq)
Ag(NH3)2+(aq),K=l.10×107 ;已知常溫下Ksp(AgCl)=1.45×10-10計算可逆反應AgCl(s) +2NH3(aq)![]() Ag(NH3)2+(aq)+Cl-(aq)的化學平衡常數K=_________(保留2位有效數字)。1L1mol/L氨水中最多可以溶解AgCl ______mol(保留1位有效數字)。
Ag(NH3)2+(aq)+Cl-(aq)的化學平衡常數K=_________(保留2位有效數字)。1L1mol/L氨水中最多可以溶解AgCl ______mol(保留1位有效數字)。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】高純MnCO3是廣泛用于電子行業的強磁性材料。MnCO3為白色粉末,不溶于水和乙醇(沸點78.5 ℃),在潮濕環境下易被氧化,溫度高于100 ℃開始分解。
I.實驗室以MnO2為原料制備MnCO3
(1)制備MnSO4溶液:
①主要反應裝置如圖所示,緩緩通入經N2稀釋的SO2氣體,發生反應H2SO3 + MnO2=MnSO4+H2O。下列措施中,目的是加快化學反應速率的是________(填字母代號)。
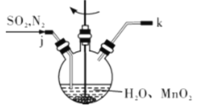
A. MnO2加入前先研磨 B.攪拌 C.提高混合氣中N2比例
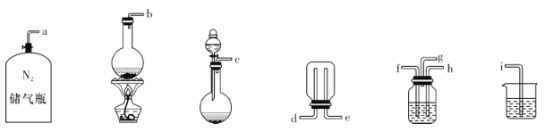
②已知實驗室制取SO2的原理是Na2SO3 +2H2SO4(濃)=2NaHSO4+SO2↑+H2O。選擇下圖所示部分裝置與上圖裝置相連制備MnSO4溶液,應選擇的裝置的接口順序為_________(用箭頭連接字母代號表示)。
③若用空氣代替N2進行實驗,缺點是_______________。( 酸性環境下Mn2+不易被氧化)
(2)制備MnCO3固體:
實驗步驟:
①向MnSO4溶液中邊攪拌邊加入飽和NH4HCO3溶液生成MnCO3沉淀,反應結束后過濾;
②...;.
③在70~80℃下烘干得到純凈干燥的MnCO3固體。
步驟②為__________,需要用到的試劑有_____________、_______、________。
II.設計實驗方案
(3)利用沉淀轉化的方法證明Ksp(MnCO3)<Ksp(NiCO3):__________________(已知NiCO3為難溶于水的淺綠色固體)。
(4)證明H2SO4的第二步電離不完全:_____________。[查閱資料表明K2(H2SO4)=1.1×10-2]
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】室溫下,向10mL0.1 mol·L-1 NaOH溶液中加入0.1mol·L-1的一元酸HA,測得溶液pH的變化曲線如圖所示,下列說法正確的是
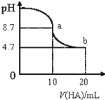
A.a點所示溶液中c(Na+)>c(A-)>c(HA)>c(OH-)
B.b點所示溶液中c(A-)>c(HA)
C.pH=7時,c(Na+)=c(A-)+c(HA)
D.a、b兩點所示溶液中水的電離程度a<b
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】工業上以硫酸泥(主要含S、Se、Fe2O3、CuO、ZnO、SiO2等)為原料提取硒,流程如圖:

(1)“脫硫”過程中,溫度控制在95℃,原因是___。
(2)“氧化”過程中,Se轉化成H2SeO3,該反應的化學方程式為___。
(3)“還原”過程是通過控制電位還原的方法將電位高的物質先還原,電位低的物質保留在溶液中。下表是將“過濾Ⅰ”所得濾液中所含物質還原對應的電位。控制電位在0.782~1.692V,可除去“過濾Ⅰ”所得濾液中殘留的ClO2。
名稱 | Cu2+/Cu | Zn2+/Zn | Fe2+/Fe | Fe3+/Fe2+ | ClO2/Cl- | H2SeO3/Se |
電位/V | 0.435 | -0.885 | -0.463 | 0.782 | 1.692 | 0.743 |
為使硒和雜質金屬分離,加入Na2SO3還原時,電位應控制在___范圍;H2SeO3(弱酸)還原為硒的離子反應方程式為___。
(4)濾液Ⅱ中主要存在的金屬陽離子有Zn2+、Na+、___。
(5)所得粗硒需精制。向粗硒浸出液中加入Na2S溶液可以將殘留的Fe2+等微量雜質離子轉化為沉淀而除去。已知25℃時Ksp(FeS)=6.0×10-18,要使溶液中Fe2+沉淀完全[c(Fe2+)≤1.0×10-5mol·L-1],則需控制溶液中c(S2-)≥___mol·L-1。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】現有反應:CO(g)+H2O(g)![]() CO2(g)+H2(g) ΔH=-43kJ/mol,在850℃時,K=1,今在某密閉容器中充入1.0molCO、3.0molH2O、1.0molCO2、xmolH2,下列說法不正確的是( )
CO2(g)+H2(g) ΔH=-43kJ/mol,在850℃時,K=1,今在某密閉容器中充入1.0molCO、3.0molH2O、1.0molCO2、xmolH2,下列說法不正確的是( )
A.900℃,該反應的平衡常數K<1
B.850℃達到平衡時,通入CO,CO轉化率將增大
C.850℃時,若x=5.0,則起始時平衡向逆反應方向移動
D.850℃時,若要使上述反應開始時向正反應方向進行,則![]() 應滿足0≤x<3
應滿足0≤x<3
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com