
【題目】某Al2O3樣品中含有一定量的Cu、Fe、Fe2O3雜質。現通過下列生產過程,從該樣品中提純Al2O3,并回收鐵紅。流程如下:
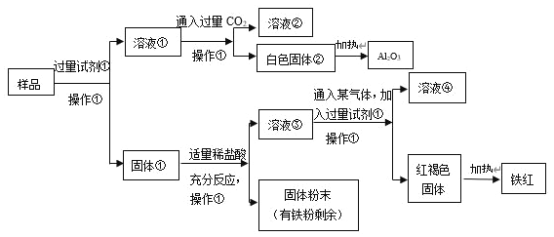
(1)操作①是_________,在實驗室進行該操作需要的玻璃儀器有_________。
(2)白色固體②是_________,樣品和試劑①反應的化學方程式是_________。
(3)固體①加入適量稀鹽酸,可能發生的反應有:_______(用化學方程式表達)。
(4)溶液③中鐵元素的存在形式是_________,如何用實驗證明:____。
(5)溶液③中通入某氣體,該氣體可以是_________(任寫一種的化學式),紅褐色固體制得鐵紅的化學方程式是_________。
【答案】過濾 燒杯、漏斗、玻璃棒 Al(OH)3 Al2O3+2NaOH=2NaAlO2+H2O Fe2O3+6HCl=2FeCl3+3H2O、2FeCl3+Fe=3FeCl2、Fe+2HCl=FeCl2+H2↑ Fe2+ 取少量溶液于試管中,滴入KSCN溶液無變化,滴加氯水后變血紅色 O2或者Cl2 2Fe(OH)3![]() Fe2O3+3H2O
Fe2O3+3H2O
【解析】
Al2O3樣品中含有一定量的Cu、Fe、Fe2O3雜質,根據題中流程圖可知,樣品與試劑①反應得溶液①再通入CO2得白色沉淀②,該白色固體加熱分解產生Al2O3,可推知試劑①為NaOH,得到的固體①為Cu、Fe、Fe2O3,溶液①為NaAlO2、NaOH混合溶液,通入過量CO2后得溶液②為NaHCO3溶液,白色固體②為Al(OH)3,Al(OH)3受熱分解得Al2O3,固體①中加入鹽酸得到固體粉末中鐵有剩余,由于Fe會發生反應2Fe3++Fe=3Fe2+,則溶液③中主要含有Fe2+,經過操作①得紅褐色固體應為Fe(OH)3,所以通入的氣體應為氧化劑,可以是O2或Cl2,氫氧化鐵受熱分解得Fe2O3。
(1)操作①是分離難溶性固體與可溶性液體混合物的方法,名稱為過濾;在實驗室進行過濾操作需要的玻璃儀器有燒杯、漏斗、玻璃棒;
(2)白色固體②受熱分解產生Al2O3,則②是Al(OH)3,樣品中含有Al2O3和試劑NaOH溶液反應產生NaAlO2和H2O,反應的化學方程式是Al2O3+2NaOH=2NaAlO2+H2O;
(3)固體①中含有Al2O3、Cu、Fe、Fe2O3,加入適量稀鹽酸,由于反應后的固體粉末中含有Fe單質,則可能發生的反應有Fe2O3+6HCl=2FeCl3+3H2O、2FeCl3+Fe=3FeCl2、Fe+2HCl=FeCl2+H2↑;
(4)由于固體①中樣品與適量鹽酸反應后的固體粉末中含有Fe,結合Fe2O3+6HCl=2FeCl3+3H2O、2Fe3++Fe=3Fe2+可知溶液③中鐵元素的存在形式是Fe2+,證明方法是:取少量該溶液于試管中,滴入KSCN溶液無變化,滴加氯水后溶液變血紅色;
(5)溶液③中含有Fe2+,向溶液③通入某氣體后再加入足量NaOH溶液,產生紅褐色的Fe(OH)3沉淀,該氣體具有強的氧化性,氣體可以是O2或者Cl2,紅褐色固體Fe(OH)3不穩定,受熱分解產生鐵紅Fe2O3,該反應的化學方程式是2Fe(OH)3![]() Fe2O3+3H2O。
Fe2O3+3H2O。


科目:高中化學 來源: 題型:
【題目】制取Na2CO3和高純Si的工藝流程如圖所示,下列說法錯誤的是
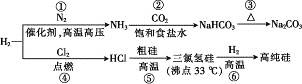
A. 反應①屬于固氮反應
B. 步驟②為先向飽和食鹽水中通入CO2至飽和后,再通入NH3
C. 反應⑤、⑥均為氧化還原反應
D. 用精餾的方法可提純三氯氫硅
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】(化學——選修3:物質的結構與性質)
鈦有“生物金屬”和“未來金屬”之稱,鈦及其化合物的應用正越來越受到人們的關注。
(1)基態鈦原子外圍電子的軌道表達式為___________。與鈦同周期的元素中,基態原子的未成對電子數與鈦相同的有___種。
(2)金屬鈦的熔點、硬度均比鋁大,可能的原因是____。
(3)TiCl4是氯化法制取鈦的中間產物。TiCl4和SiCl4在常溫下都是液體,分子結構相同。采用蒸餾的方法分離TiCl4和SiCl4的混合物,先獲得的餾分是__________ (填化學式)。

(4)半夾心結構催化劑M能催化乙烯、丙烯、苯乙烯等的聚合,其結構如圖所示。
①組成該物質的元素中,電負性最大的是__________ (填元素名稱)。
②M中碳原子的雜化形式有___________種。
③M中不含__________ (填字母代號)。
a.π鍵 b.σ鍵 c.配位鍵
d.氫鍵 e.離子鍵

(5)①金屬鈦晶體中原子采用面心立方最密堆積,則晶胞中鈦原子的配位數為_____。
②設鈦原子的直徑為d cm,用NA表示阿伏加德羅常數的值,鈦原子的摩爾質量為M g·mol-1,則晶體鈦的密度為________g·cm-3。
③金屬鈦晶胞中有若干個正四面體空隙,如圖中a、b、c、d四個鈦原子形成一個正四面體,其內部為正四面體空隙,可以填充其他原子。若晶胞中所有的正四面體空隙中都填充氫原子,那么形成的氫化鈦的化學式為__________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】NA為阿伏加德羅常數的值,下列敘述正確的是
A. 18 g D2O中含有的質子數為10NA
B. 60 g二氧化硅中含有的Si—O鍵數目為4NA
C. 密閉容器中,2 mol NO與1 mol O2充分反應,產物的分子數為2NA
D. 標準狀況下,22.4 L氯氣通入足量水中充分反應后轉移電子數為NA
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】(舉一反三)下列說法正確的是( )
A.在稀硫酸中加入銅粉,銅粉不溶解,再加入Cu(NO3)2固體,銅粉仍不溶解
B.銅與濃硝酸反應的離子方程式為Cu+4H++2NO![]() ===Cu2++2NO2↑+2H2O
===Cu2++2NO2↑+2H2O
C.1.0 mol·L-1的KNO3溶液中可大量存在H+、Fe2+、Cl-、SO![]()
D.硫化銅溶于硝酸的離子方程式為CuS+2H+===H2S↑+Cu2+
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】某固定容積為1L的密閉容器中,1molA(g)與1molB(g)在催化劑作用下加熱到500℃發生反應:A(g)+B(g)![]() C(g)+2D(s) ΔH>0,下列有關說法正確的是
C(g)+2D(s) ΔH>0,下列有關說法正確的是
A. 升高溫度,![]() 增大,
增大,![]() 逆減小
逆減小
B. 平衡后再加入1molB,上述反應的ΔH增大
C. 通入稀有氣體,壓強增大,平衡向正反應方向移動
D. 若B的平衡轉化率為50%,則該反應的平衡常數等于2
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】用一種陰、陽離子雙隔膜三室電解槽處理廢水中的NH4+,模擬裝置如圖所示。下列說法正確的是( )
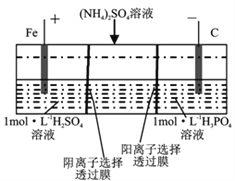
A. 陽極室溶液由無色變成棕黃色
B. 陰極的電極反應式為:4OH--4e-=2H2O+O2↑
C. 電解一段時間后,陰極室溶液中的pH升高
D. 電解一段時間后,陰極室溶液中的溶質一定是(NH4)3PO4
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】Ⅰ.中國傳統文化是人類文明的瑰寶,古代文獻中記載了大量古代化學的研究成果。回答下面問題:
(1)我國最原始的陶瓷約出現在距今12000年前,制作瓷器所用的原料是高嶺士,其晶體化學式是Al4[Si4O10](OH)8,用氧化物表示其組成為______________。
(2)《本草綱目》中記載:“(火藥)乃焰消( KNO3)、硫磺、杉木炭所合,以為烽燧銃機諸藥者。”反應原理為:S+2KNO3+3C![]() K2S+N2↑+3CO2↑,該反應的氧化劑是____ ,反應轉移4mol電子時,被S氧化的C有____mol。
K2S+N2↑+3CO2↑,該反應的氧化劑是____ ,反應轉移4mol電子時,被S氧化的C有____mol。
(3)我國古代中藥學著作《新修本草》記載的藥物有844種,其中有關“青礬”的描述為:“本來綠色,新出窟未見風者,正如瑁璃…燒之赤色…。”我國早期科技叢書《物理小適-金石類》 記載有加熱青礬時的景象:“青礬廠氣熏人,衣服當之易爛,載木不盛。”青礬就是綠礬( FeSO4·7H2O)。根據以上信息,寫出“青礬”受熱分解的化學方程式_________________。
Ⅱ.“鋼是虎,釩是翼,鋼含釩猶如虎添翼”,釩是“現代工業的味精”。釩對稀酸是穩定的,但室溫下能溶解于濃硝酸中生成VO2+。
(4)請寫出金屬釩與濃硝酸反應的離子方程式:_______________________________。
(5)V2O5是兩性氧化物,與強堿反應生成釩酸鹽(陰離子為VO43-),溶于強酸生成含釩氧離子(VO2+)的鹽。請寫出V2O5分別與燒堿溶液和稀硫酸反應生成的鹽的化學式:_____________、 _____________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】某興趣小組探究SO2氣體還原Fe3+,他們使用的藥品和裝置如下圖所示,下列說法不合理的是( )
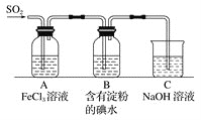
A.能表明I-的還原性弱于SO2的現象是B中藍色溶液褪色
B.裝置C的作用是吸收SO2尾氣,防止污染空氣
C.為了驗證A中發生了氧化還原反應,加入KMnO4溶液,紫紅色褪去
D.為了驗證A中發生了氧化還原反應,加入用稀鹽酸酸化的BaCl2溶液,產生白色沉淀
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com