
【題目】X、Y、Z、W均為中學化學的常見物質,一定條件下它們之間有如下轉化關系:
![]()
(1)若W為一種一元強堿,Y具有兩性,X到Z的離子方程式為_____________。
(2)若X是一種黃綠色的氣體,Y的飽和溶液滴入沸水中能生成紅褐色膠體。
①檢驗溶液Z是否變質最靈敏的一種試劑是____________________(名稱);
②Y與W轉化為Z的離子反應方程式_________________________________;
③一定條件下W與水反應的化學方程式_______________________________。
(3)X常溫下為氣體化合物,Z是一種紅棕色氣體,X氣體的檢驗方法____________________,X轉化為Y的化學方程式為______________________;Z與水反應的過程中,氧化劑與還原劑的質量比為__________________。
(4)X為一元強堿溶液,W是形成酸雨的主要氣體。
①則Y到Z的離子方程式為________________________________________;
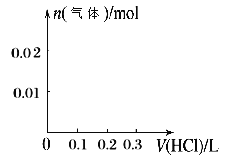
②請畫出向含0.01molX和0.01molY的溶液中逐滴加入0.1mol/L稀鹽酸的體積和生成氣體的物質的量的關系的圖像___________。
【答案】Al3+ +4OH—= AlO2—+2H2O 硫氰化鉀溶液 2Fe3+ + Fe === 3Fe2+ 3Fe + 4H2O(g) === Fe3O4 + 4H2 使濕潤的紅色石蕊試紙變藍(或遇蘸有濃鹽酸的玻璃棒產生白煙) 4NH3+5O2![]() 4NO+6H2O 1:2 SO32-+SO2+H2O=2HSO3-
4NO+6H2O 1:2 SO32-+SO2+H2O=2HSO3- 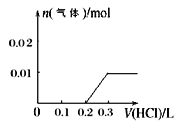
【解析】
)
(1)Y具有兩性是突破點,得出Y為氫氧化鋁,Z為偏鋁酸鹽,X為鋁鹽,寫出離子方程式;
(2)X是一種黃綠色的氣體,得出X為氯氣,Y的飽和溶液滴入沸水中能生成紅褐色膠體,得出Y為氯化鐵,Z為氯化亞鐵,W為鐵;
(3)Z是一種紅棕色氣體,得出Z為NO2,逆推可得X為NH3,W為氧氣,Y為NO;
(4)W是形成酸雨的主要氣體,得出W為SO2,由于亞硫酸為二元酸,所以二氧化硫與強堿反應可以生成正鹽與酸式鹽,得出Y為亞硫酸鈉,Z為亞硫酸氫鈉。
(1)若W為一種一元強堿,Y為Al(OH)3,Z為偏鋁酸鹽,X為鋁鹽,X到Z的離子方程式為Al3+ +4OH—= AlO2—+2H2O。
正確答案:Al3+ +4OH—= AlO2—+2H2O;
(2)X是一種黃綠色的氣體,得出X為氯氣,Y的飽和溶液滴入沸水中能生成紅褐色膠體,得出Y為氯化鐵,Z為氯化亞鐵,W為鐵;
①亞鐵離子容易被氧化為鐵離子,檢驗變質最靈敏的試劑一般選特征反應,所以選擇硫氰化鉀溶液;
②氯化鐵與鐵轉化為氯化亞鐵的離子反應方程式2Fe3+ + Fe === 3Fe2+;
③一定條件下鐵與水蒸汽可以反應的化學方程式3Fe + 4H2O(g) === Fe3O4 + 4H2。
正確答案:硫氰化鉀溶液 2Fe3+ + Fe === 3Fe2+ 3Fe + 4H2O(g) === Fe3O4 + 4H2。
(3)Z是一種紅棕色氣體,得出Z為NO2,逆推可得X為NH3,W為氧氣,Y為NO;NH3氣體的檢驗方法是使濕潤的紅色石蕊試紙變藍(或遇蘸有濃鹽酸的玻璃棒產生白煙)NH3轉化為NO的化學方程式為4NH3+5O2![]() 4NO+6H2O;NO2與水反應3NO2+H2O=2HNO3+NO,氧化劑與還原劑的均為NO2,質量比等于物質的量之比,根據化合價的變化,氧化劑升失氧,還原劑降得還,可得出氧化劑與還原劑的質量比為1:2;
4NO+6H2O;NO2與水反應3NO2+H2O=2HNO3+NO,氧化劑與還原劑的均為NO2,質量比等于物質的量之比,根據化合價的變化,氧化劑升失氧,還原劑降得還,可得出氧化劑與還原劑的質量比為1:2;
正確答案:使濕潤的紅色石蕊試紙變藍(或遇蘸有濃鹽酸的玻璃棒產生白煙) 4NH3+5O2![]() 4NO+6H2O 1:2 。
4NO+6H2O 1:2 。
(4)W是形成酸雨的主要氣體,得出W為SO2,由于亞硫酸為二元酸,所以與強堿反應可以生成正鹽與酸式鹽,得出Y為亞硫酸鈉,Z為亞硫酸氫鈉;
①則亞硫酸鈉到亞硫酸氫鈉的離子方程式為SO32-+SO2+H2O=2HSO3- ;
②向含0.01mol一元強堿和0.01mol亞硫酸鈉的溶液中逐滴加入0.1mol/L稀鹽酸的體積和生成氣體的物質的量的關系的圖像分為三步:第一步:H++OH-=H2O;第二步:SO32- + H+= HSO3-;第三步:HSO3-+ H+= SO2+H2O,據此畫出圖像 ;
;
正確答案:


 新非凡教輔沖刺100分系列答案
新非凡教輔沖刺100分系列答案科目:高中化學 來源: 題型:
【題目】[化學——選修3:物質結構與性質]
鋅在工業中有重要作用,也是人體必需的微量元素。回答下列問題:
(1)Zn原子核外電子排布式為________________。
(2)黃銅是人類最早使用的合金之一,主要由Zn和Cu組成。第一電離能Ⅰ1(Zn)_______Ⅰ1(Cu)(填“大于”或“小于”)。原因是________________。
(3)ZnF2具有較高的熔點(872 ℃),其化學鍵類型是_________;ZnF2不溶于有機溶劑而ZnCl2、ZnBr2、ZnI2能夠溶于乙醇、乙醚等有機溶劑,原因是________________。
(4)《中華本草》等中醫典籍中,記載了爐甘石(ZnCO3)入藥,可用于治療皮膚炎癥或表面創傷。ZnCO3中,陰離子空間構型為________________,C原子的雜化形式為________________。
(5)金屬Zn晶體中的原子堆積方式如圖所示,這種堆積方式稱為_______________。六棱柱底邊邊長為a cm,高為c cm,阿伏加德羅常數的值為NA,Zn的密度為________________g·cm-3(列出計算式)。

查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】25℃時,下列有關溶液中粒子的物質的量濃度關系正確的是
A. 0.1 mol·L-1 Na2CO3與0.l mol·L-1 NaHCO3溶液等體積混合:2/3 c(Na+) = c(CO32-) + c(HCO3-) + c(H2CO3)
B. 0.1 mol·L-1 Na2C2O4與0.1 mol·L-1 HCl溶液等體積混合(H2C2O4為二元弱酸):2c(C2O42-)+c(HC2O4-)+c(OH-)=c(Na+)+c(H+)
C. 0.1 mol·L-1 CH3COONa與0.l mol·L-1 HCl 溶液等體積混合:c(Na+) = c(Cl-) > c(OH-) > c(CH3COO-)
D. 0.l mol·L-1 NH4Cl與0.l mol·L-1氨水等體積混合(pH > 7): c(NH3·H2O) > c(NH4+) > c(Cl-) > c(OH-)
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】如圖所示,關閉活塞,向甲、乙兩剛性密閉容器中分別充入1 mol A、2 mol B,此時甲、乙的容積均為2 L(連通管體積忽略不計)。在T℃時,兩容器中均發生下述反應:A(g)+2B(g)![]() 2C(g)+3D(g) △H < 0。達平衡時,乙的體積為2.6 L,下列說法正確的是
2C(g)+3D(g) △H < 0。達平衡時,乙的體積為2.6 L,下列說法正確的是
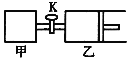
A. 甲中反應的平衡常數小于乙
B. 若打開活塞K,達平衡時乙容器的體積為3.2 L
C. 當乙中A與B的體積分數之比為1:2時,反應達到平衡狀態
D. 平衡時甲容器中A的物質的量小于0.55 mol
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】油脂不僅是營養物質和主要食物,也是一種重要的工業原料。下面是以油脂為主要原料獲得部分產品的合成路線:

己知:①G (C10H10O4)分子中的官能團處于對位;
②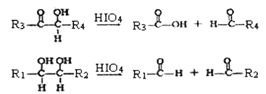
(R1、R2、R3與R4可能是氫、烴基或其他基團)
回答下列問題:
(1)下列關于油脂的說法正確的是____。(填標號)
a.油脂包括植物油和脂肪,屬于酯類
b.天然油脂是混合甘油酯組成的混合物,無固定的熔點和沸點
c.油脂屬天然高分子化合物,許多油脂兼有烯烴的化學性質
d.硬化油又叫人造脂肪,便于儲存和運輸,但容易被空氣氧化變質
(2)G中官能團的名稱為______,反應①的反應類型為_________。
(3)用系統命名法寫出F的名稱___________。
(4)在酸催化下物質的量的B與苯酚反應生成一種線型結構高分子的化學方程式為______________________。
(5)二元取代芳香化合物H是G的同分異構體,H滿足下列條件:
①能發生銀鏡反應
②酸性條件下水解產物物質的量之比為2:1
③不與NaHCO3溶液反應。
則符合上述條件的H共有______種(不考慮立體結構,不包含G本身)。其中核磁共振氫譜為五組峰的結構簡式為________(寫出一種即可)。
(6)寫出從HOCH2CH2OH![]() HCOOCH2CH2OOCH的合成路線(無機試劑任選,合成路線參照題中的書寫形式)______________。
HCOOCH2CH2OOCH的合成路線(無機試劑任選,合成路線參照題中的書寫形式)______________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】微量元素在生物體內含量雖然很少,卻是維持正常生命活動不可缺少的。這可通過下面的哪一實例得到證實( )
A.缺Mg時葉片變黃
B.油菜缺B時只開花不結果
C.動物血液中鈣鹽的含量太低會抽搐
D.缺P會導致作物植株矮小
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】設NA為阿伏伽德羅常數的值,下列說法正確的是
A. 22.4L CO2與足量Na2O2完全反應,轉移電子數為2NA
B. 6.4 g 由S2、S4、S8組成的混合物含硫原子數為0.2NA
C. 1mol/L的NaCl溶液中Cl—的數目為NA
D. 標況下,22.4L NO和11.2L O2,混合后氣體分子數為NA
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com