
【題目】如圖所示,A是氧化物,可作干燥劑;D是一種鈉鹽,用于制造玻璃,洗滌劑等,它們之間發生如圖變化,請你根據所學的化學知識作出推斷:
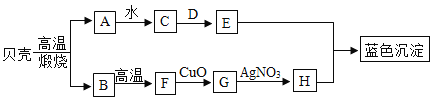
(1)A______,D______;
(2)貝殼高溫煅燒的化學方程式_____;
(3)B![]() F的化學方程式_____;E+H→藍色沉淀的化學方程式是______.
F的化學方程式_____;E+H→藍色沉淀的化學方程式是______.
(4)反應G![]() H基本反應類型是______反應.
H基本反應類型是______反應.
【答案】CaO Na2CO3 CaCO3![]() CaO+CO2↑ CO2+C
CaO+CO2↑ CO2+C![]() 2CO 2NaOH+Cu(NO3)2=Cu(OH)2↓+2NaNO3 置換
2CO 2NaOH+Cu(NO3)2=Cu(OH)2↓+2NaNO3 置換
【解析】
根據框圖,貝殼的成分是碳酸鈣,高溫煅燒生成氧化鈣和二氧化碳,A是氧化物,可作干燥劑,所以A是氧化鈣,B是二氧化碳,那C就是氫氧化鈣,又D是一種鹽,用于制造玻璃,洗滌劑等,故D是碳酸鈉,E為氫氧化鈉,二氧化碳在高溫下與碳反應生成一氧化碳,故F為一氧化碳,在判斷G為銅,H為硝酸銅,代入驗證,推理正確。
(1)A是氧化鈣,D碳酸鈉,化學式為:CaO,Na2CO3;
(2)貝殼的主要成分是碳酸鈣,高溫分解生成氧化鈣和二氧化碳,反應的化學方程式為:CaCO3![]() CaO+CO2↑;
CaO+CO2↑;
(3)B是二氧化碳,二氧化碳在高溫下與碳反應生成一氧化碳,E為氫氧化鈉,H為硝酸銅,E與H反應生成氫氧化銅藍色沉淀和硝酸鈉,反應的化學方程式為:CO2+C![]() 2CO,2NaOH+Cu(NO3)2=Cu(OH)2↓+2NaNO3;
2CO,2NaOH+Cu(NO3)2=Cu(OH)2↓+2NaNO3;
(4)G為銅,與硝酸銀反應生成銀和硝酸銅,此反應屬于置換反應。


科目:初中化學 來源: 題型:
【題目】一包不純的Na2CO3固體,雜質可能是CuSO4、KNO3、CaCl2、NaHCO3中的一種或幾種。現取該樣品溶于水得到無色澄清溶液,另取樣品10.6g,加入100g稀硫酸恰好完全反應,產生氣體4.6g,則下列判斷正確的是( )
A.樣品中一定沒有CuSO4、CaCl2,一定有NaHCO3
B.樣品中一定含有KNO3,可能含有NaHCO3
C.樣品中一定含有NaHCO3,可能含有KNO3
D.所加的稀硫酸溶質的質量分數不大于9.8%
查看答案和解析>>
科目:初中化學 來源: 題型:
【題目】同學們在學習酸堿的化學性質時構建了如圖知識網絡,A、B、C、D是不同類別的物質,“-”表示物質在一定條件下可以發生化學反應。請回答下列問題:
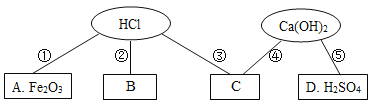
(1)B是我國年產量最多的金屬,它的名稱為___________。
(2)反應①的化學方程式為____________,實驗現象為____________。
(3)反應④可用于工業上制燒堿,則其化學方程式為_____,基本反應類型為____。
查看答案和解析>>
科目:初中化學 來源: 題型:
【題目】將銅、氧化銅、氫氧化銅混合粉末25g在加熱條件下用氫氣還原,反應完全后,測得有0.5g氫氣參加了反應,同時有6.3g水生成。試計算該混合物中銅、氧化銅、氫氧化銅各多少克。
查看答案和解析>>
科目:初中化學 來源: 題型:
【題目】化學知識就在我們身邊.
(1)打開冰箱聞到一股異味,建議放一包活性炭,這是利用了活性炭的______.
(2)廚房所用的燃料是天然氣,優點是______(答一點即可),其燃燒的化學方程式為_______;
(3)人們的生活離不開金屬,若鐵制品表面已銹蝕,請寫出用鹽酸除去鐵銹的化學方程式為_______.
(4)人們的生活離不開燃燒,可燃物燃燒除需要氧氣外,還需要滿足的條件是____;煤塊粉碎后,在空氣中燃燒得更快、更充分,這是因為_____.
查看答案和解析>>
科目:初中化學 來源: 題型:
【題目】向某硫酸和硫酸銅的混合溶液中加入某濃度的氫氧化鈉溶液,產生沉淀的質量與加入氫氧化鈉溶液的質量關系如圖所示。下列說法正確的是
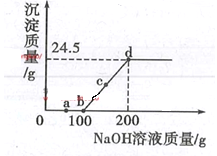
A.a點溶液中含有兩種溶質
B.bc段發生反應的類型為置換反應、
C.根據圖中收據計算出氫氧化鈉溶液的濃度
D.d點濃液中主要存在的離子為Na+、Cu2+、OH-、SO42-
查看答案和解析>>
科目:初中化學 來源: 題型:
【題目】銅片在空氣中久置表面會變綠。某小組同學設計并進行實驗,探究銅變綠的條件。
(查閱資料)(1)、銅綠的成分是堿式碳酸銅![]() ,堿式碳酸銅能夠與鹽酸反應。
,堿式碳酸銅能夠與鹽酸反應。
(2)、濃硫酸具有吸水性,可以作為一些氣體的干燥劑。
(猜想與假設)常溫下,銅片變綠可能與![]() 、
、![]() 、水蒸氣有關。
、水蒸氣有關。
(進行實驗)利用下圖1裝置分別制取并收集氣體于試管中,制取氣體原理及收集氣體等操作見下表。將收集好的氣體,用圖2所示裝置進行4個實驗,通過控制與銅片接觸的物質,進行實驗并持續觀察實驗現象。
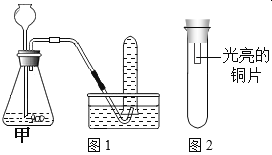
編號 | 主要實驗操作 | 實驗現象 |
1 | 甲中盛有過氧化氫溶液和二氧化錳,收集一試管氣體 | 銅片始終無明顯變化 |
2 | 甲中盛有大理石和稀鹽酸,收集一試管氣體 | 銅片始終無明顯變化 |
3 | 甲處先用過氧化氫溶液和二氧化錳反應收集半試管氣體,再換盛有大理石和稀鹽酸的裝置,繼續收集至一試管氣體 | 一段時間后銅片變綠 |
4 | 甲處先用過氧化氫溶液和二氧化錳反應收集半試管氣體,再換盛有大理石和稀鹽酸的裝置,繼續收集至一試管氣體,并向氣體中加入適量濃硫酸 | 銅片始終無明顯變化 |
(解釋與結論)
(1)實驗1的目的是驗證______。
(2)實驗2制取氣體反應的化學方程式為______。
(3)得出“銅片變綠一定與![]() 有關”的結論,依據的兩個實驗是______
有關”的結論,依據的兩個實驗是______![]() 填編號
填編號![]() 。
。
(4)實驗4中,試管內的氣體主要含有______。
(5)上述實驗可推知,銅片變綠的條件是______。
(討論與交流)
(6)同學們猜想堿式碳酸銅與鹽酸反應有二氧化碳生成,證明此猜想所需試劑是______。
查看答案和解析>>
科目:初中化學 來源: 題型:
【題目】小宇為了測定實驗室中氯酸鉀樣品的純度,取10g樣品與1g二氧化錳混合,依次加熱該混合物t1、t2、t3、t4時間后,分別冷卻稱量剩余固體質量,記錄的有關數據如下表(樣品中的雜質不參與化學反應)
加熱時間 | t1 | t2 | t3 | t4 |
剩余固體質量(g) | 9.68 | 9.04 | 7.16 | 7.16 |
試計算:
(1)完全反應后產生的氧氣的總質量為_____________g;
(2)樣品中氯酸鉀的純度是____(寫出計算過程)
(3)加熱時間t1后,9.68g剩余固體中除雜質外還含有的物質為_____________。
查看答案和解析>>
科目:初中化學 來源: 題型:
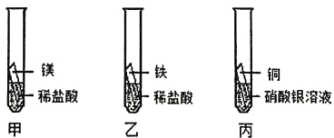
【題目】某興趣小組為探究 Mg、Fe、Cu、Ag 四種金屬的活動性進行如下實驗。(注:所用金屬大小形狀相同、酸的體積濃度相同)
![]()
①甲、乙試管中的實驗現象為_______,依據甲乙試管中產生此現象的速率甲大于乙,可知活動性 Mg___Fe(填“>”、“=”或“<”);
②根據丙中現象_____________,可知活動性 Cu>Ag;
③小組同學隨后發現該實驗無法得出四種金屬的活動性順序,于是補充圖丁試管中實驗,最終得出四種金屬活動性:Mg>Fe>Cu>Ag,則補充實驗中的試劑A、B 分別為____________
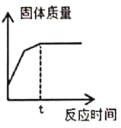
④為了減少環境污染,小組同學將乙中剩余的鐵加入丙溶液中回收丙溶液溶質的金屬,至t時間后固體質量不再變化,根據上圖所示溶液中固體質量變化情況,分析最后所得固體的成分為__________。
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com