
【題目】金屬及金屬材料在生產、生活中有廣泛的應用。
(1)近年來,我市開展文明城市創建工作,垃圾分類回收是其中一項重要舉措。某市街道垃圾桶如圖所示,請回答下列問題:
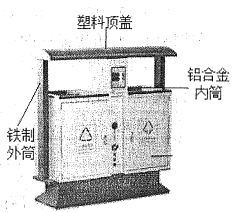
①圖中標識的物質,屬于金屬材料的是_______________ (寫出一種即可)。
②某品牌飲料的空易拉罐應收入_______________(填 “可回收”或“不可回收”)筒中。
③鐵制品銹蝕的過程,實際上是鐵跟空氣中的_____________發生化學反應的過程。
(2)將甲、乙、兩三種金屬分別投入稀硫酸中,甲、丙表面有氣泡產生。乙無明顯現象;若將甲放入丙的硫酸鹽溶液中,一段時間后,甲的表面有丙析出。由此推斷這三種金屬的活動性由強到弱的顧序是_______________。
(3)將一定質量的鐵粉加入到Al(NO3)3、 Cu(NO3)2、AgNO3三種物質的混合溶液中,充分反應后過濾,得到濾液和濾渣。下列有關說法正確的是__________(填字母)。
A 若濾液為藍色,則濾渣中一定有銀,可能有銅
B 若濾渣中含有銀、銅、鐵,則濾液中一定含有A13+、Fe3+、 NO3-
C 若濾液為淺綠色,則濾渣中一定含銀、銅、鋁
D 若濾渣中加稀鹽酸無氣泡產生,則溶液中一定有A13+、Fe3+、Cu2+,可能有Ag+
(4)用一氧化碳治煉2000t含雜質3%的生鐵。需要含四氧化三鐵90%的磁鐵礦的質量是__________t結果精確到 0.1。
(5)某金屬粉末可能由鎂、鋅、鐵、鋁、銀中的一種或幾種組成。取該樣品2.4g,向其中加入100g 一定溶質量分數的稀硫酸,恰好完全反應生成0.2g 氫氣,得到無色溶液,固體無剩余。下列說法正確的是____ (填序號)。
A 樣品中一定含有鎂
B 樣品中一定不含有銀,可能含有鎂
C 所得溶液中溶質總質量為12g
D 加入的稀硫酸的溶質質量分數為19.6%
【答案】鐵制外筒、鋁合金內筒 可回收 水和氧氣 甲>丙>乙 A 2976.7t BC
【解析】
金屬材料包括純金屬和合金,金屬生銹是金屬和水和氧氣共同作用的結果,鐵和硝酸銀反應生成銀和硝酸亞鐵,鐵和硝酸銅反應生成硝酸亞鐵和銅,鎂和稀硫酸反應生成硫酸鎂和氫氣,鋅和稀硫酸反應生成硫酸鋅和氫氣,鐵和稀硫酸反應生成硫酸亞鐵和氫氣,鋁和稀硫酸反應生成硫酸鋁和氫氣。
(1)①金屬材料包括純金屬和合金,故圖中標識的物質,屬于金屬材料的是鐵制外筒、鋁合金內筒。
②空易拉罐屬于可回收垃圾,故某品牌飲料的空易拉罐應收入可回收筒中。
③金屬生銹是金屬和水和氧氣共同作用的結果,故鐵制品銹蝕的過程,實際上是鐵跟空氣中的水和氧氣發生化學反應的過程。
(2)將甲、乙、兩三種金屬分別投入稀硫酸中,甲、丙表面有氣泡產生,乙無明顯現象,說明甲、丙的金屬活動性強于乙,若將甲放入丙的硫酸鹽溶液中,一段時間后,甲的表面有丙析出,說明甲的金屬活動性強于丙,故這三種金屬的活動性由強到弱的顧序是甲>丙>乙。
(3)A、由金屬活動性順序表可知,鐵、鋁、銅、銀四種金屬活動性順序為鋁>鐵>銅>銀,將一定質量的鐵粉加入到Al(NO3)3、 Cu(NO3)2、AgNO3三種物質的混合溶液中,鐵和硝酸銀先反應生成硝酸亞鐵和銀,然后鐵和硝酸銅反應生成硝酸亞鐵和銅,若濾液為藍色,說明含有硝酸銅,硝酸銀反應完全,則濾渣中一定有銀,可能有銅,故A正確;
B、將一定質量的鐵粉加入到Al(NO3)3、 Cu(NO3)2、AgNO3三種物質的混合溶液中,鐵和硝酸銀先反應生成硝酸亞鐵和銀,然后鐵和硝酸銅反應生成硝酸亞鐵和銅,若濾渣中含有銀、銅、鐵,說明硝酸銀和硝酸銅反應完全,則濾液中一定含有A13+、Fe2+、 NO3-,故B不正確;
C、鐵先和硝酸銀反應生成硝酸亞鐵和銀,然后鐵和硝酸銅反應生成硝酸亞鐵和銅,若濾液為淺綠色,鐵和硝酸鋁不反應,濾渣中一定不含鋁,故C不正確;
D、鐵先和硝酸銀反應生成硝酸亞鐵和銀,然后鐵和硝酸銅反應生成硝酸亞鐵和銅,若濾渣中加稀鹽酸無氣泡產生,說明鐵反應完全,則溶液中一定有A13+、Fe2+,可能有Cu2+和Ag+,故D不正確。故選A。
(4)設需要含四氧化三鐵90%的磁鐵礦的質量是x

![]()
![]()
故需要含四氧化三鐵90%的磁鐵礦的質量是2976.7t。
(5)A、鎂、鋅、鐵、鋁和稀硫酸反應的關系式為![]() ,
,![]() ,
,![]() ,
,![]() ,2.4鎂和稀硫酸完全反應生成0.2g氫氣,2.4g鋁和稀硫酸反應生成氫氣的質量大于0.2g,2.4g鋅和稀硫酸反應生成氫氣的量小于0.2g,2.4g鐵和稀硫酸反應生成氫氣的量小于0.2g,則金屬可能是鎂,故A不正確;
,2.4鎂和稀硫酸完全反應生成0.2g氫氣,2.4g鋁和稀硫酸反應生成氫氣的質量大于0.2g,2.4g鋅和稀硫酸反應生成氫氣的量小于0.2g,2.4g鐵和稀硫酸反應生成氫氣的量小于0.2g,則金屬可能是鎂,故A不正確;
B、向其中加入100g 一定溶質量分數的稀硫酸,恰好完全反應,得到無色溶液,固體無剩余,樣品中一定不含有銀,2.4鎂和稀硫酸完全反應生成0.2g氫氣,可能含有鎂,故B正確;
C、反應生成0.2g氫氣,氫元素全部來自硫酸,參加反應的硫酸的質量![]() ,所得溶液中溶質總質量為
,所得溶液中溶質總質量為![]() ,故C正確;
,故C正確;
D、參加反應的硫酸的質量![]() ,加入的稀硫酸的溶質質量分數為
,加入的稀硫酸的溶質質量分數為![]() ,故D不正確。故選BC。
,故D不正確。故選BC。


 閱讀快車系列答案
閱讀快車系列答案科目:初中化學 來源: 題型:
【題目】甲、乙兩種物質的溶解度曲線如圖所示。下列說法正確的是( )
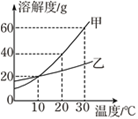
A. 依據溶解度曲線可判斷,甲的溶解度比乙大
B. 10℃時,甲、乙飽和溶液溶質的質量相同
C. 20℃時,把30g甲放入50g水中形成的溶液中溶質質量分數為37.5%
D. 將20℃時的甲、乙飽和溶液升溫至30℃,甲、乙溶液中溶質的質量分數均不變
查看答案和解析>>
科目:初中化學 來源: 題型:
【題目】我國著名化學家侯德榜先生發明的侯氏制堿法,因原料利用率高,并能進行連續生產,從而享譽中外。某課外興趣小組同學,按照“侯氏制堿法”原理,設計了如下圖所示一套實驗裝置。
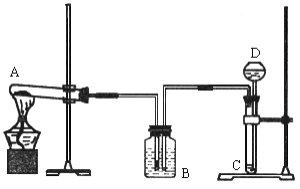
實驗室可供選用的藥品有:濃氨水、純堿、大理石、稀鹽酸、稀硫酸、熟石灰、氯化
銨、氯化鈉。
(1)A、D 中最合適的試劑為:A_______,D_______(填名稱)。
(2)本實驗在具體操作過程中,應先通______氣體,再通______氣體,原因是_______。
(3)小紅同學認為實驗裝置中存在某些不足,請指出其中的一處錯誤_________。
(4)在改進裝置后,小麗同學進行了實驗,實驗所用的飽和氯化鈉溶液中含溶質 58.5g,實驗最后得到無水碳酸鈉 26.0g,針對實驗結果,該同學認真分析了造成損失的原因,發現其操作步驟并沒有錯誤,則主要原因是___________。
查看答案和解析>>
科目:初中化學 來源: 題型:
【題目】黃銅渣中約含![]() 7%、
7%、![]() 31%、
31%、![]() 50%、
50%、![]() 5%,其余為雜質。處理黃銅渣可得到硫酸鋅,其主要流程如圖所示(雜質不溶于水、不參與反應)。
5%,其余為雜質。處理黃銅渣可得到硫酸鋅,其主要流程如圖所示(雜質不溶于水、不參與反應)。
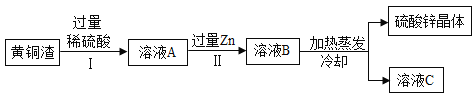
已知:![]() ;
;![]()
①Ⅱ中反應的化學方程式為________。
②下列說法正確的是________。
a Ⅰ、Ⅱ中的操作均包含過濾 b 溶液A中![]() 的質量大于
的質量大于![]()
c 溶液A的質量小于溶液B d 溶液C中溶質的質量分數小于溶液B
查看答案和解析>>
科目:初中化學 來源: 題型:
【題目】如圖化學反應的溶液顏色變化體現了“魔法世界、魅力化學”(→表示可以轉化生 成),其中推斷正確的是( )
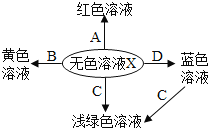
A. X是酸,C一定是Fe
B. X是鹽,A一定是酚酞試液
C. X是酸,B可能是金屬氧化物
D. X是酸,D可能是CuSO4
查看答案和解析>>
科目:初中化學 來源: 題型:
【題目】根據下圖所示實驗,不能達到實驗目的的是
A. 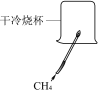 檢驗CH4燃燒生成CO2和H2OB.
檢驗CH4燃燒生成CO2和H2OB.  探究分子在不斷運動
探究分子在不斷運動
C.  稀釋濃硫酸D.
稀釋濃硫酸D.  加熱高錳酸鉀制取氧氣
加熱高錳酸鉀制取氧氣
查看答案和解析>>
科目:初中化學 來源: 題型:
【題目】在抗擊新冠肺炎中,75%的酒精和84消毒液在殺滅病毒方面發揮了重要作用。
(1)84消毒液[有效成分為次氯酸鈉(NaClO)和二氧化氯(ClO2)],其中NaClO中氯元素的化合價為_____,ClO2屬于_____(填序號)。
A 化合物
B 混合物
C 氧化物
(2)乙醇,俗稱酒精,在人們的生活中扮演重要的角色。體積分數為75%的酒精溶液常用作消毒劑,里面的溶質是______。在配制溶液時將75 mL酒精和25 mL水混合時,發現體積小于100 mL,這是因為______。
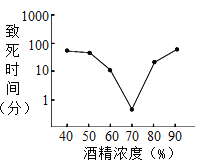
(3)如圖為常溫下,某科研小組測量不同濃度的酒精溶液殺滅金黃色葡萄球菌所需時間的實驗結果。分析右圖得到的結論是______。
(4)乙醇是一種清潔能源。科學家利用新型催化劑,將二氧化碳轉化為液態燃料乙醇,反應的微觀示意如下:
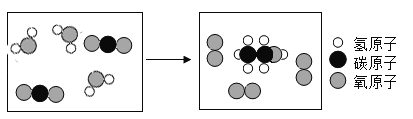
下列說法正確的是________(填序號)。
A 乙醇由2個碳原子、1個氧原子、6個氫原子構成
B 乙醇中氫、氧元素的質量比為3∶8
C 若有44 g CO2反應,則生成O2 48 g
(5)酒精易燃,使用不當會引發火災。實驗時,不小心有一些酒精灑落在實驗臺上并且燃燒,正確的操作是用濕布蓋滅,其滅火原理是________。
查看答案和解析>>
科目:初中化學 來源: 題型:
【題目】Cu與Zn的合金稱為黃銅,有優良的導熱性和耐腐蝕性,可用作各種儀器零件.某化學興趣小組的同學為了測定某黃銅的組成,取10g該黃銅樣品于燒杯中,向其中分5次加入相同溶質質量分數的稀硫酸,使之充分反應.每次所用稀硫酸的質量及剩余固體的質量記錄于下表:
加入稀硫酸的質量(g) | 充分反應后剩余固體的質量(g) | |
第1次 | 10 | m |
第2次 | 10 | 7.4 |
第3次 | 10 | 6.1 |
第4次 | 10 | 5.6 |
第5次 | 10 | 5.6 |
試回答下列問題:
(1)從以上數據可知,最后剩余的5.6g固體的成分是 ;表格中,m= .
(2)黃銅樣品中鋅的質量分數為 .
(3)計算所用稀硫酸中硫酸的質量分數是多少?
查看答案和解析>>
科目:初中化學 來源: 題型:
【題目】I. 銅是生活中常見的金屬,請回答下列問題:
(1)Cu 不活潑,通常情況下不與稀硫酸反應,但向 Cu 和稀硫酸的混合物中滴入 H2O2 后,溶液很快變藍色,試寫出該反應的化學方程式 __________________。
(2)將硫酸銅溶液和碳酸鈉溶液混合,會析出 Cu2(OH)2CO3 綠色固體,試寫出該反應的化學方程式______。
(3)火法煉銅的原理為:![]() ,下列說法中,正確的是 _______。
,下列說法中,正確的是 _______。
A Cu2S 只做還原劑
B O2 發生氧化反應
C S 元素被氧化
D 當 2 mol O2參加反應時,共轉移了 10 mol 電子
II. 有一種固體混合物質 M,其中只可能含有 Na2CO3、NaNO3、Na2SO4、CuCl2、 BaCl2 中的一種或幾種。請根據以下實驗操作回答下列問題。
操作① 取少量 M 放入足量的水中充分攪拌、靜置,得到白色沉淀和無色溶液,過濾。
操作② 向濾出的沉淀中加入足量稀硝酸,沉淀全部溶解,此時所得溶液仍為無色。
(1)M 中不能確定是否含有的物質是__________。
(2)上述實驗過程中,發生反應的化學方程式為 ___________、 ________。
(3)向操作①后所得的無色溶液中滴加溶液 AgNO3溶液,一定能發生的反應的化學方程式為_____。
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com