
題目列表(包括答案和解析)
硫酸亞鐵銨的化學(xué)式為(NH4)2SO4·FeSO4·6H2O,又名莫爾鹽,是分析化學(xué)中常見的還原劑。某化學(xué)研究小組設(shè)計(jì)如下實(shí)驗(yàn)來制備莫爾鹽并測(cè)定硫酸亞鐵銨的純度。
步驟一:鐵屑的處理與稱量。在盛有適量鐵屑的錐形瓶中加入Na2CO3溶液,加熱、過濾、洗滌、干燥、稱量,質(zhì)量記為m1。
步驟二:FeSO4的制備。將上述鐵屑加入到一定量的稀硫酸中,充分反應(yīng)后過濾并用少量熱水洗滌錐形瓶和濾紙。濾液及洗滌液完全轉(zhuǎn)移至蒸發(fā)皿中。濾渣干燥后稱重,質(zhì)量記為m2。
步驟三:硫酸亞鐵銨的制備。準(zhǔn)確稱取所需質(zhì)量的(NH4)2SO4加入“步驟二”中的蒸發(fā)皿中,緩緩加熱一段時(shí)間后停止,冷卻,待硫酸亞鐵銨結(jié)晶后過濾。晶體用無水乙醇洗滌并自然干燥,稱量所得晶體質(zhì)量。
步驟四:用比色法測(cè)定硫酸亞鐵銨的純度。
回答下列問題:
(1)步驟三中稱取的(NH4)2SO4質(zhì)量為________。
(2)①鐵屑用Na2CO3溶液處理的目的是_______________________________。
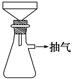
制備FeSO4溶液時(shí),用右圖裝置趁熱過濾,原因是
_______________________________________________________________。
②將(NH4)2SO4與FeSO4混合后加熱、濃縮,停止加熱的時(shí)機(jī)是
________________________________________________________________________。
③比色法測(cè)定硫酸亞鐵銨純度的實(shí)驗(yàn)步驟為:Fe3+標(biāo)準(zhǔn)色階的配制、待測(cè)硫酸亞鐵銨溶液的配制、比色測(cè)定。標(biāo)準(zhǔn)色階和待測(cè)液配制時(shí)除均需加入少量稀鹽酸外,還應(yīng)注意的問題是________________________________________________________________________。
④該實(shí)驗(yàn)最終通過____________________確定硫酸亞鐵銨產(chǎn)品等級(jí)。
下列兩題分別對(duì)應(yīng)于“物質(zhì)結(jié)構(gòu)與性質(zhì)”和“實(shí)驗(yàn)化學(xué)”兩個(gè)選修課程模塊的內(nèi)容,請(qǐng)你選擇其中一題作答,如果兩題全做,則按A題評(píng)分。
A.(12分)【物質(zhì)結(jié)構(gòu)與性質(zhì)】
1915年諾貝爾物理學(xué)獎(jiǎng)授予Henry Bragg和Lawrence Bragg,以表彰他們用X射線對(duì)晶體結(jié)構(gòu)的分析所作的貢獻(xiàn)。
⑴科學(xué)家通過X射線探明,NaCl、KCl、MgO、CaO晶體結(jié)構(gòu)相似,其中三種晶體晶格能數(shù)據(jù)如下表:
| 晶體 | NaCl | KCl | CaO |
| 晶格能/(kJ·mol-1) | 786 | 715 | 3 401 |
4種晶體NaCl、KCl、MgO、CaO熔點(diǎn)由高到低的順序是 ▲ 。
⑵科學(xué)家通過X射線推測(cè)膽礬中既含有配位鍵,又含有氫鍵,其結(jié)構(gòu)示意圖可簡(jiǎn)單表示如下,其中配位鍵和氫鍵均采用虛線表示。

①寫出基態(tài)Cu原子的核外電子排布式 ▲ ;金屬銅采用下列 ▲ (填字母代號(hào))堆積方式。
 |
A B C D
②寫出膽礬晶體中水合銅離子的結(jié)構(gòu)簡(jiǎn)式(必須將配位鍵表示出來) ▲ 。
③水分子間存在氫鍵,請(qǐng)你列舉兩點(diǎn)事實(shí)說明氫鍵對(duì)水的性質(zhì)的影響 ▲ 。
④SO42-的空間構(gòu)型是 ▲ 。
B.(12分)【實(shí)驗(yàn)化學(xué)】
硫酸亞鐵銨的化學(xué)式為(NH4)2SO4·FeSO4·6H2O,又名莫爾鹽,是分析化學(xué)中常見的還原劑。某化學(xué)研究小組設(shè)計(jì)如下實(shí)驗(yàn)來制備莫爾鹽并測(cè)定硫酸亞鐵銨的純度。
步驟一:鐵屑的處理與稱量。在盛有適量鐵屑的錐形瓶中加入Na2CO3溶液,加熱,過濾、洗滌、干燥、稱量,質(zhì)量記為m1。
步驟二:FeSO4的制備。將上述鐵屑加入到一定量的稀H2SO4中,充分反應(yīng)后過濾并用少量熱水洗滌錐形瓶和濾紙。濾液及洗滌液完全轉(zhuǎn)移至蒸發(fā)皿中。濾渣干燥后稱重,質(zhì)量記為m2。
步驟三:硫酸亞鐵銨的制備。準(zhǔn)確稱取所需質(zhì)量的(NH4)2SO4加入“步驟二”中的蒸發(fā)皿中,緩緩加熱一段時(shí)間后停止,冷卻,待硫酸亞鐵銨結(jié)晶后過濾。晶體用無水乙醇洗滌并自然干燥,稱量所得晶體質(zhì)量。
步驟四:用比色法測(cè)定硫酸亞鐵銨的純度。
 回答下列問題:
回答下列問題:
⑴步驟三中稱取的(NH4)2SO4質(zhì)量為 ▲ 。
⑵①鐵屑用Na2CO3溶液處理的目的是 ▲ 。制備FeSO4溶液時(shí),用右圖裝置趁熱過濾,原因是 ▲ 。
②將(NH4)2SO4與FeSO4混合后加熱、濃縮,停止加熱的時(shí)機(jī)是 ▲ 。
③比色法測(cè)定硫酸亞鐵銨純度的實(shí)驗(yàn)步驟為:Fe3+標(biāo)準(zhǔn)色階的配制、待測(cè)硫酸亞鐵銨溶液的配制、比色測(cè)定。標(biāo)準(zhǔn)色階和待測(cè)液配制時(shí)除均需加入少量稀HCl溶液外,還應(yīng)注意的問題是 ▲ 。
④該實(shí)驗(yàn)最終通過 ▲ 確定硫酸亞鐵銨產(chǎn)品等級(jí)。
硫酸亞鐵銨的化學(xué)式為(NH4)2SO4·FeSO4·6H2O,商品名為莫爾鹽。可由硫酸亞鐵與硫酸銨反應(yīng)生成硫酸亞鐵銨,一般硫酸亞鐵鹽在空氣中易被氧化,而形成莫爾鹽后就比較穩(wěn)定了。三種鹽的溶解度(單位為g/100g水)如下表:
| 溫度/℃ | 10 | 20 | 30 | 40 | 50 | 70 |
| (NH4)2SO4 | 73.0 | 75.4 | 78.0 | 81.0 | 84.5 | 91.9 |
| FeSO4·7H2O | 40.0 | 48.0 | 60.0 | 73.3 | - | - |
| (NH4)2SO4??FeSO4??6H2O | 17.2 | 26.4 | 33.0 | 46.0 | — | — |
實(shí)驗(yàn)室制取少量莫爾鹽的流程如下:

試回答下列問題:
(1)步驟1中加入10%Na2CO3溶液的主要作用是除去鐵屑表面的油污,簡(jiǎn)述其除去油污的原理
(2)將(NH4)2SO4與FeSO4混合后加熱、濃縮,停止加熱的時(shí)機(jī)
(3)步驟4中析出的晶體不含(NH4)2SO4和FeSO4的原因是 ,理論上制得的莫爾鹽的質(zhì)量為 。
(二)稱取兩份質(zhì)量均為1.96g的該硫酸亞鐵銨,制成溶液。用未知濃度的KMnO4酸性溶液進(jìn)行滴定。
(1)滴定時(shí),將KMnO4酸性溶液裝在_______(填“酸式”或“堿式”)滴定管。試寫出該滴定過程中的離子方程式:___ __;
(2)判斷該反應(yīng)到達(dá)滴定終點(diǎn)的現(xiàn)象為 ;
(3)假設(shè)到達(dá)滴定終點(diǎn)時(shí),用去V mL KMnO4酸性溶液,則該KMnO4酸性溶液的濃度為 mol/L
(11分)硫酸亞鐵銨的化學(xué)式為(NH4)2SO4•FeSO4•6H2O,商品名為莫爾鹽。可由硫酸亞鐵與硫酸銨反應(yīng)生成硫酸亞鐵銨,一般硫酸亞鐵鹽在空氣中易被氧化,而形成莫爾鹽后就比較穩(wěn)定了。三種鹽的溶解度(單位為g/100g水)如下表:
溫度/℃ | 10 | 20 | 30 | 40 | 50 | 70 |
(NH4)2SO4 | 73.0 | 75.4 | 78.0 | 81.0 | 84.5 | 91.9 |
FeSO4?7H2O | 40.0 | 48.0 | 60.0 | 73.3 | - | - |
(NH4)2SO4•FeSO4•6H2O | 17.2 | 26.4 | 33.0 | 46.0 | ― | ― |
(一)實(shí)驗(yàn)室制取少量莫爾鹽的流程如下:
 |
試回答下列問題:
(1)步驟1中加入10%Na2CO3溶液的主要作用是除去鐵屑表面的油污,簡(jiǎn)述其除去油污的原理
(2)將(NH4)2SO4與FeSO4混合后加熱、濃縮,停止加熱的時(shí)機(jī)
(3)步驟4中析出的晶體不含(NH4)2SO4和FeSO4的原因是 ,理論上制得的莫爾鹽的質(zhì)量為 。
(二)稱取兩份質(zhì)量均為1.96g的該硫酸亞鐵銨,制成溶液。用未知濃度的KMnO4酸性溶液進(jìn)行滴定。
(1)滴定時(shí),將KMnO4酸性溶液裝在_______(填“酸式”或“堿式”)滴定管。試寫出該滴定過程中的離子方程式:_ ___ __;
(2)判斷該反應(yīng)到達(dá)滴定終點(diǎn)的現(xiàn)象為 ;
(3)假設(shè)到達(dá)滴定終點(diǎn)時(shí),用去V mL KMnO4酸性溶液,則該KMnO4酸性溶液的濃度為 mol/L
| 溫度/℃ | 10 | 20 | 30 |
| (NH4)2SO4 | 73.0 | 75.4 | 78.0 |
| FeSO4?7H2O | 20.0 | 26.5 | 32.9 |
| (NH4)2SO4?FeSO4 | 17.2 | 21.6 | 28.1 |

| 1 |
| V |
| 1 |
| V |
一、選擇題(本題包括9小題,每小題3分,共27分。每小題只有一個(gè)選項(xiàng)符合題意)
題號(hào)
1
2
3
4
5
6
7
8
9
答案
B
C
A
C
D
B
C
A
A
二、選擇題(本題包括9小題,每小題4分,共36分。每小題有一個(gè)或兩個(gè)選項(xiàng)符合題意。若正確答案包括兩個(gè)選項(xiàng),只選一個(gè)且正確得2分,但只要選錯(cuò)一個(gè)就得0分)
題號(hào)
10
11
12
13
14
15
16
17
18
答案
BC
A
D
BD
AC
AC
C
C
BD
三、(本題包括3小題,共34分)
19.(一)(6分)
(1)熱的Na2CO3會(huì)發(fā)生水解反應(yīng)使溶液堿性,在堿性條件下使油脂充分水解而除去(2分)
(2) 濃縮至液體表面出現(xiàn)潔凈薄膜(1分)
(3) 在相同溫度下,(NH4)2SO4•FeSO4•6H2O的溶解度比(NH4)2SO4、FeSO4小(1分) ;
7(m1―m2)g (1分)
(二).(共5分)
(1)酸式(1分) 5Fe2+ + MnO4- + 8H+= 5Fe3++ Mn2+ + 4H2O(2分)
(2)當(dāng)最后一滴KMnO4酸性溶液滴下時(shí),溶液變成紫色,30s內(nèi)不褪色,說明達(dá)到滴定終點(diǎn)(1分)
(3)1/V(1分)
20.(10分)
[交流與討論](1)2AI+2NaOH+2H20=2NaAl02+3H2 ↑ (2分)
(2)97mL (2分)
(3)濾紙破損;過濾時(shí)漏斗里的液面高于濾紙邊緣;儀器不干凈等(1分)
(4)偏高 (1分)
[實(shí)驗(yàn)拓展](4分) 
21、(13分)
(1)①產(chǎn)生二氧化硫沒有干燥,水蒸氣會(huì)與Na2O2反應(yīng);②在B、C之間加一個(gè)裝有NaOH溶液的洗氣瓶 除去SO2氣體(每空1分,共3分)
(2) 2Na2O2+2CO2=2Na2CO3+O2↑(2分)
①提出合理假設(shè)
假設(shè)1:白色固體為Na2SO3 假設(shè)2:白色固體為Na2SO3與Na2SO4 的混合物
假設(shè)3:白色固體為Na2SO4(每空1分,共3分)
② (每空1分,共5分)
實(shí)驗(yàn)操作
預(yù)期現(xiàn)象與結(jié)論
步驟1:取少量白色固體于試管,加入足量的稀鹽酸
若聞到刺激性氣味,說明白色固體含有Na2SO3.
步驟2:在步驟1的溶液加入足量的氯化鋇溶液
若有白色沉淀生成,則說明白色固體含Na2SO4.
若步驟1現(xiàn)象明顯,而步驟2沒明顯現(xiàn)象,則說明白色固體為Na2SO3;若步驟1現(xiàn)象不明顯,步驟2現(xiàn)象明顯,則說明白色固體為Na2SO4;若上述兩個(gè)實(shí)驗(yàn)現(xiàn)象均有,則說明白色固體既含有Na2SO3,又含有Na2SO4。
四、(本題包括3小題,共34分)
22.(12分)
(1)硅(2分)(2)原子 ,C3N4 ,高溫、高壓 (各2分,共6分)
(3)4Al + 3O2 = 2Al2O3 IIA(各2分,共4分)
23(14分)
(1)CuO+2H+→Cu2++H2O(2分)
(2)燒杯、量筒(4分,各2分)
(3)SO2(2分)
(4)取少許樣品,加入稀H2SO4,若溶液出現(xiàn)藍(lán)色,說明紅色物質(zhì)中含有Cu2O,反之則沒有(2分)
(5)銅粉的質(zhì)量(2分) 最終所得CuO的質(zhì)量(2分)。
24 (8分)
(1)NO2(g)+CO(g)=CO2(g)+NO(g) △H=-234kJ?mol-1(2分)
(2)①>(2分) ②C(2分)
(3)①N2H62++H2O [N2H5?H2O]++H+(2分)
[N2H5?H2O]++H+(2分)
五、(本題包括1小題,9分)
25(9分)
(1)C6H6(1分)
(2)碳碳雙鍵 酯基 (每個(gè)1分,共2分)
(3)分別取少量粗品和純品于試管,分別加入NaHCO3溶液,若試管中有氣泡產(chǎn)生,則原試劑為粗品。(其它合理答案也給分)(2分)
 |
(4) (2分)
(5) ;
; (每個(gè)1分,共2分)
(每個(gè)1分,共2分)
六、選做題(本題包括2小題,每小題10分,考生只能選做一題)
26.(10分)
⑴加成反應(yīng) 消去反應(yīng) 取代反應(yīng) (3分)
⑵ +2NaOH→
+2NaOH→ +2NaBr (2分)
+2NaBr (2分)
⑶ ③; 保護(hù)A分子中C=C不被氧化
 (5分)
(5分)
27.(10分)
(1)1s22s22p63s23p6 (1分)
(2)ZCl<Ycl<XCl (1分)
(3) Cu 4 (每空2分,共4分)
(4) CH3―CH2―Cl中與Cl原子成鍵的C以sp3雜化,而CH2=CH2―Cl中與Cl原子成鍵的C以sp2雜化,電子云密度不同;CH3―CH2―Cl中的C―Cl的鍵長(zhǎng)比CH2=CH2―Cl中C―Cl要長(zhǎng);CH2=CH2―Cl的∏鍵對(duì)Cl的作用力比CH3―CH2―Cl的a鍵強(qiáng)。
(答對(duì)兩點(diǎn)給2分)
(5)HF沸點(diǎn)比HCl高;氫氟酸是弱酸,鹽酸是強(qiáng)酸;實(shí)驗(yàn)測(cè)得HF分子質(zhì)量偏大。
(答對(duì)兩點(diǎn)給2分)
國(guó)際學(xué)校優(yōu)選 - 練習(xí)冊(cè)列表 - 試題列表
湖北省互聯(lián)網(wǎng)違法和不良信息舉報(bào)平臺(tái) | 網(wǎng)上有害信息舉報(bào)專區(qū) | 電信詐騙舉報(bào)專區(qū) | 涉歷史虛無主義有害信息舉報(bào)專區(qū) | 涉企侵權(quán)舉報(bào)專區(qū)
違法和不良信息舉報(bào)電話:027-86699610 舉報(bào)郵箱:58377363@163.com