
題目列表(包括答案和解析)
化學反應原理對于工業生產和科研有重要意義
I、下列三個化學反應的平衡常數(K1、K2、K3)與溫度的關系分別如下表所示:
| 化學反應 | 平衡常數 | 溫度 | |
| 973 K | 1173 K | ||
①Fe(s)+CO2(g) FeO(s)+CO(g) FeO(s)+CO(g) | K1 | 1.47 | 2.15 |
②Fe(s)+H2O(g) FeO(s)+H2(g) FeO(s)+H2(g) | K2 | 2.38 | 1.67 |
③CO(g) +H2O(g) CO2(g) +H2(g) CO2(g) +H2(g) | K3 | ? | ? |


| 化學反應 | 平衡常數 | 溫度 | |
| 973 K | 1173 K | ||
①Fe(s)+CO2(g) FeO(s)+CO(g) FeO(s)+CO(g) | K1 | 1.47 | 2.15 |
②Fe(s)+H2O(g) FeO(s)+H2(g) FeO(s)+H2(g) | K2 | 2.38 | 1.67 |
③CO(g) +H2O(g) CO2(g) +H2(g) CO2(g) +H2(g) | K3 | ? | ? |
I、已知反應:
3I-(aq)+S2O82-(aq) ![]() I3-(aq)+2SO42-(aq);
I3-(aq)+2SO42-(aq);
(1)寫出反應的平衡常數表達式
 K= 。
K= 。
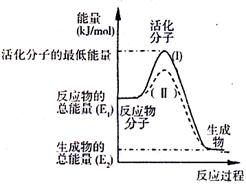
(2)右圖表示反應過程中有關物質的能量,則反應
的 △H 0(填>、<、=)。
(I)、(II)兩線中,使用催化劑的是 線。
(3)反應中發生反應的I-與被氧化的I-的物質的量比為 。
(4)反應的速率可以用I3-與加入的淀粉溶液反應是藍色的時間t來度量,t越小,反應速率越大。某探究性學習小組在20℃進行實驗,記錄的數據如下:
| 實驗編號 | ① | ② | ③ | ④ | ⑤ |
| c(I-)/mol·L-1 | 0.040 | 0.080 | 0.080 | 0.160 | 0.160 |
| c(S2O82-/mol·L-1) | 0.040 | 0.040 | 0.080 | 0.080 | 0.040 |
| t/s | 88 | 44 | 22 | 11 | t1 |
則:該實驗的目的是
顯色時間t1= s
分析表中數據,得出的結論是
II、二氧化硫和氮的氧化物是常用的化工原料,但也是大氣的主要污染物。綜合治理其污染是環境化學當前的重要研究內容之一。
硫酸生產中,SO2催化氧化生成SO3:2SO2(g)+O2(g) ![]() 2SO3(g)
2SO3(g)
某溫度下,SO2的平衡轉化率(α)與體系總壓強(p)的關系如右圖所示。
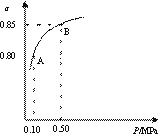 根據圖示回答下列問題。
根據圖示回答下列問題。
①平衡狀態由A變到B時,平衡常數K(A) K(B)
(填“>”、“<”、“=”)。
②已知上述反應的是放熱反應,當該反應處于平衡狀態時,
在體積不變的條件下,下列選項中有利于提高SO2平衡轉
化率的有 (填字母)。
A.升高溫度 B.降低溫度 C.增大壓強 D.減小壓強
E.加入催化劑 F.移出氧氣
節能減排是當今社會的熱門話題,研發混合動力汽車對于中國汽車業的未來具有重要的戰略意義。混合動力汽車持續工作時間長,動力性好的優點,無污染、低噪聲的好處,汽車的熱效率可提高10%以上,廢氣排放可改善30%以上,某種混合動力汽車的動力系統由“1.6L汽油機十自動變速器十20kW十200V鎳氫電池”組成。
①混合動力汽車所用的燃料之一是乙醇,lg乙醇完全燃燒生成CO2氣體和液態H2O放出30.0kJ熱量,寫出乙醇燃燒的燃燒熱的熱化學方程式???????????? 。
 ②鎳氫電池的使用可以減少對環境的污染,它采用儲氫金屬為負極,堿液NaOH為電解液,鎳氫電池充電時發生反應?????????????????????????????????? 。其放電時的正極的電極反應方程式為???????? 。
②鎳氫電池的使用可以減少對環境的污染,它采用儲氫金屬為負極,堿液NaOH為電解液,鎳氫電池充電時發生反應?????????????????????????????????? 。其放電時的正極的電極反應方程式為???????? 。
③常溫下,同濃度的Na2CO3溶液和NaHCO3溶液的pH都大于7,兩者中哪種的pH更大,其原因是???? 。0.1mol·L-1 Na2CO3中陰離子濃度大小關系是??? ,向0.1mol·L-1 NaHCO3溶液中滴入少量氫氧化鋇溶液,則發生反應的離子方程式為:????????????? 。
(2)二氧化錳、鋅是制備干電池的重要原料,工業上用軟錳礦(含MnO2)和閃鋅礦(含ZnS)
聯合生產二氧化錳、鋅的工藝如下:

①操作Ⅰ需要的玻璃儀器是?????? 。
②軟錳礦(含MnO2)和閃鋅礦與硫酸反應的化學方程式為 ????? ,上述電解過程中,當陰極生成6.5g B時陽極生成的MnO2的質量為 ???? 。
③利用鋁熱反應原理,可以從軟錳礦中提取錳,發生的化學方程式為?????? 。
節能減排是當今社會的熱門話題,研發混合動力汽車對于中國汽車業的未來具有重要的戰略意義。混合動力汽車持續工作時間長,動力性好的優點,無污染、低噪聲的好處,汽車的熱效率可提高10%以上,廢氣排放可改善30%以上,某種混合動力汽車的動力系統由“1.6L汽油機十自動變速器十20kW十200V鎳氫電池”組成。
①混合動力汽車所用的燃料之一是乙醇,lg乙醇完全燃燒生成CO2氣體和液態H2O放出30.0kJ熱量,寫出乙醇燃燒的燃燒熱的熱化學方程式 。 ②鎳氫電池的使用可以減少對環境的污染,它采用儲氫金屬為負極,堿液NaOH為電解液,鎳氫電池充電時發生反應 。其放電時的正極的電極反應方程式為 。
②鎳氫電池的使用可以減少對環境的污染,它采用儲氫金屬為負極,堿液NaOH為電解液,鎳氫電池充電時發生反應 。其放電時的正極的電極反應方程式為 。
③常溫下,同濃度的Na2CO3溶液和NaHCO3溶液的pH都大于7,兩者中哪種的pH更大,其原因是 。0.1mol·L-1 Na2CO3中陰離子濃度大小關系是 ,向0.1mol·L-1 NaHCO3溶液中滴入少量氫氧化鋇溶液,則發生反應的離子方程式為: 。
(2)二氧化錳、鋅是制備干電池的重要原料,工業上用軟錳礦(含MnO2)和閃鋅礦(含ZnS)
聯合生產二氧化錳、鋅的工藝如下:
①操作Ⅰ需要的玻璃儀器是 。
②軟錳礦(含MnO2)和閃鋅礦與硫酸反應的化學方程式為 ,上述電解過程中,當陰極生成6.5g B時陽極生成的MnO2的質量為 。
③利用鋁熱反應原理,可以從軟錳礦中提取錳,發生的化學方程式為 。
一、選擇題(本題包括21小題,每小題2分,共42分。)
1.D 2.C 3.C 4.D 5.C 6.C 7.D 8 .D 9.C 10.C
11.B 12.C 13.C 14.C 15.D 16.C 17.B 18.D 19.B 20.A二、本題包括1小題,共12分。
21.(12分)
(1)B中裝無水硫酸銅,檢驗水蒸氣;C中裝澄清的石灰水,檢驗二氧化碳;(每空1分)
(2)驗純后點燃E處的氣體,火焰呈藍色。(2分,不答“驗純”扣1分)
(3)點燃前應驗純;CO有毒,實驗要通風;加熱時要均勻受熱等。(2分)
(4)揮發出來的草酸蒸氣與石灰水反應生成了草酸鈣沉淀,會干擾 的檢驗(2分)
的檢驗(2分)
在裝置B和C裝置間增加―個裝有水(或燒堿溶液)的洗氣裝置(2分)
三、本題包括3小題,共38分。
22.(每空2分,共12分)
(1)
 (2) >
(2) >
(3)
(4) (5) 336
(5) 336
23.(每空2分,共12分)
(1)A:Si B:Mg (2)抑制氯化鎂水解
(3) ①
③
④
24.(每空2分,共14分)
(1) (2)
(2)
(3) 負極反應產物
負極反應產物
(4)①
②
③
四、本題包括1小題,共10分。
25.(1) (2分)
(2分)
 (2分)
(2分)
(2)解:設生成 的物質的量為
的物質的量為 。由上述方程式知:
。由上述方程式知:






生成 的質量為:
的質量為: (2分)
(2分)
(3)①5、1、8、1、5、4 (2分) ②83.33% (2分)
(2分) ②83.33% (2分)
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com