
題目列表(包括答案和解析)
下表標(biāo)出的是元素周期表的一部分元素,回答下列問題:
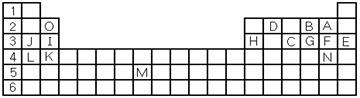
(1)表中用字母標(biāo)出的15種元素中,金屬性最強的主族元素是 (用元素符號表示,下同),非金屬性最強的是 ,常溫下單質(zhì)為液態(tài)的非金屬元素是 ,屬于過渡元素的是 (該空用字母表示)。
(2)B,F(xiàn),C氣態(tài)氫化物中以 最不穩(wěn)定。(填化學(xué)式)
(3)除稀有氣體外第三周期中原子半徑最小的是 。(填元素符號)
(4)寫出I、H元素的最高價氧化物對應(yīng)水化物的酸(或堿)性強弱順序 >
(用化學(xué)式表示)
(9分)下表標(biāo)出的是元素周期表的一部分元素,回答下列問題:
(1)表中用字母標(biāo)出的15種元素中,金屬性最強的是 (用元素符號表示,下同),非金屬性最強的是 ,常溫下單質(zhì)為液態(tài)的非金屬元素是 ,屬于過渡元素的是 (該空用字母表示)。
(2)B,F(xiàn),C氣態(tài)氫化物中以 最不穩(wěn)定。(填化學(xué)式)
(3)除稀有氣體外第三周期中原子半徑最小的是 。(填元素符號)
(4)寫出I、H元素的最高價氧化物對應(yīng)水化物的酸(或堿)性強弱順序 > (用化學(xué)式表示)
(5)B的氫化物電子式為 用電子式表示G的氫化物形成過程 ,(物質(zhì)用化學(xué)式表示)
(9分)下表標(biāo)出的是元素周期表的一部分元素,回答下列問題:
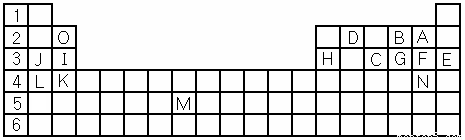
(1)表中用字母標(biāo)出的15種元素中,金屬性最強的是 (用元素符號表示,下同),非金屬性最強的是 ,常溫下單質(zhì)為液態(tài)的非金屬元素是 ,屬于過渡元素的是 (該空用字母表示)。
(2)B,F(xiàn),C氣態(tài)氫化物中以 最不穩(wěn)定。(填化學(xué)式)
(3)除稀有氣體外第三周期中原子半徑最小的是 。(填元素符號)
(4)寫出I、H元素的最高價氧化物對應(yīng)水化物的酸(或堿)性強弱順序 > (用化學(xué)式表示)
(5)B的氫化物電子式為 用電子式表示G的氫化物形成過程 ,(物質(zhì)用化學(xué)式表示)
下表標(biāo)出的是元素周期表的一部分元素,回答下列問題:
(1)表中用字母標(biāo)出的15種元素中,金屬性最強的主族元素是 (用元素符號表示,下同),非金屬性最強的是 ,常溫下單質(zhì)為液態(tài)的非金屬元素是 ,屬于過渡元素的是 (該空用字母表示)。
(2)B,F(xiàn),C氣態(tài)氫化物中以 最不穩(wěn)定。(填化學(xué)式)
(3)除稀有氣體外第三周期中原子半徑最小的是 。(填元素符號)
(4)寫出I、H元素的最高價氧化物對應(yīng)水化物的酸(或堿)性強弱順序 >
(用化學(xué)式表示)
(9分)下表標(biāo)出的是元素周期表的一部分元素,回答下列問題:
(1)表中用字母標(biāo)出的15種元素中,金屬性最強的是 (用元素符號表示,下同),非金屬性最強的是 ,常溫下單質(zhì)為液態(tài)的非金屬元素是 ,屬于過渡元素的是 (該空用字母表示)。
(2)B,F(xiàn),C氣態(tài)氫化物中以 最不穩(wěn)定。(填化學(xué)式)
(3)除稀有氣體外第三周期中原子半徑最小的是 。(填元素符號)
(4)寫出I、H元素的最高價氧化物對應(yīng)水化物的酸(或堿)性強弱順序 > (用化學(xué)式表示)
(5)B的氫化物電子式為 用電子式表示G的氫化物形成過程 ,(物質(zhì)用化學(xué)式表示)
1.D 2.B 3.B 4.D 5.A 6.AD 7.D 8.AD 9.A 10.AC 11.AC
12.D 13.BC 14.D 15.C 16.D 17.A 18.B 19.A 20.A 21.C 22.D
23.(1)CuS、S (2)6∶1∶4
(3)

24.(1)D (2)> (3)B
25.解析:(1)
(2)因 中的
中的 ,
, 中的
中的 ,故依電子得失守恒有(x+1)×25.00×0.1000=5×30.00×0.0500,解之,x+2,即
,故依電子得失守恒有(x+1)×25.00×0.1000=5×30.00×0.0500,解之,x+2,即 被氧化成+2價氮的氧化物NO.又因V×C×2=30.00×0.0500×5,故
被氧化成+2價氮的氧化物NO.又因V×C×2=30.00×0.0500×5,故 .依題意知,
.依題意知,


 .所以
.所以 與
與 反應(yīng)的方程式為
反應(yīng)的方程式為

 w.w.w.k.s.5.u.c.o.m
w.w.w.k.s.5.u.c.o.m
26.解析:這是一道天平平衡問題的計算.兩個燒杯的質(zhì)量相等.兩個燒杯里鹽酸溶液的質(zhì)量相等.因此論證天平兩個燒杯內(nèi)反應(yīng)體系質(zhì)量改變量相等是解決本題的關(guān)鍵.由題意可知:
 溶液增重
溶液增重
100 56
a
 溶液增重
溶液增重
84 40
x 40x/84
當(dāng)0.3 mol HCl與 恰好完全反應(yīng)時,消耗
恰好完全反應(yīng)時,消耗 的質(zhì)量為:
的質(zhì)量為: 時;0.3 mol HCl與
時;0.3 mol HCl與 恰好完全反應(yīng),消耗
恰好完全反應(yīng),消耗 的質(zhì)量為:0.3×84=
的質(zhì)量為:0.3×84=
(1)a≤ 、
、 均過量,天平保持平衡的條件是:
均過量,天平保持平衡的條件是:
 x=
x=
(2)a> 不足,且對于
不足,且對于 恰好完全反應(yīng)時,加入
恰好完全反應(yīng)時,加入 的燒杯內(nèi)反應(yīng)體系的增重量為a-0.15×44,而加入
的燒杯內(nèi)反應(yīng)體系的增重量為a-0.15×44,而加入 的燒杯內(nèi)反應(yīng)體系的增重量為0.3×40.則天平保持平衡的條件是:
的燒杯內(nèi)反應(yīng)體系的增重量為0.3×40.則天平保持平衡的條件是:
a-0.15×44=0.3×40 a=18.6
因此,18.6≥a>15時,天平保持平衡的條件是:
 x=2,
x=2,
(3)當(dāng)a>18.6時,天平保持平衡的條件是:a-0.15×44=x-0.3×44
x=a+6.6
因為燒杯中無固體剩余,說明a≤15. 、
、 的摩爾質(zhì)量相當(dāng),當(dāng)?shù)荣|(zhì)量的
的摩爾質(zhì)量相當(dāng),當(dāng)?shù)荣|(zhì)量的 、
、 與酸完全反應(yīng)時,生成
與酸完全反應(yīng)時,生成 質(zhì)量相等.所以天平保持平衡時:x=a≤15
質(zhì)量相等.所以天平保持平衡時:x=a≤15
27.解析:題中涉及化學(xué)反應(yīng)如下: w.w.w.k.s.5.u.c.o.m
w.w.w.k.s.5.u.c.o.m
 ①
①
 ②
②
 ③
③
(1)當(dāng)剩余固體為 ,排出氣體為
,排出氣體為 、
、 時,因為沒有NaOH生成,水未與
時,因為沒有NaOH生成,水未與 反應(yīng).將方程式①×2+②得:
反應(yīng).將方程式①×2+②得:

由方程式可知: .
.
(2)當(dāng)剩余固體為 、NaOH,排出氣體為
、NaOH,排出氣體為 、
、 時,由于有NaOH生成,所以有水與
時,由于有NaOH生成,所以有水與 反應(yīng).假設(shè)反應(yīng)后無
反應(yīng).假設(shè)反應(yīng)后無 生成,將方程式①×2+②+③得:
生成,將方程式①×2+②+③得:

由方程式可知此時 .因為有水生成,所以
.因為有水生成,所以
(3)當(dāng) 時,由2討論可知:剩余固體為
時,由2討論可知:剩余固體為 、NaOH、
、NaOH、 ;排出氣體為
;排出氣體為 .
.
(4)當(dāng)排出的 和
和 為等物質(zhì)的量時,依方程式討論有:
為等物質(zhì)的量時,依方程式討論有:

2b b b

b b 
設(shè)反應(yīng)的 的物質(zhì)的量為x
的物質(zhì)的量為x

x x 
依題意有:

所以,反應(yīng)中消耗 的物質(zhì)的量為:
的物質(zhì)的量為: ,用去
,用去 的物質(zhì)的量為:
的物質(zhì)的量為:
 w.w.w.k.s.5.u.c.o.m
w.w.w.k.s.5.u.c.o.m
所以,
28.(1)0~50℃時, 不發(fā)生分解,固體物質(zhì)質(zhì)量不變
不發(fā)生分解,固體物質(zhì)質(zhì)量不變
(2)50℃~ 分解的結(jié)果,結(jié)晶水全部失去
分解的結(jié)果,結(jié)晶水全部失去

179 143

(3)100℃~ 穩(wěn)定且不發(fā)生分解,故固體質(zhì)量不變
穩(wěn)定且不發(fā)生分解,故固體質(zhì)量不變
(4)214℃~ 發(fā)生了分解
發(fā)生了分解

143 55+16x
0.80 0.40
x≈1 y=1.5,
故反應(yīng)方程式為
(5)280℃~ 反應(yīng)生成高價態(tài)氧化物
反應(yīng)生成高價態(tài)氧化物
 方程式為
方程式為

29.解:假設(shè)反應(yīng)后的混合物標(biāo)況下仍為氣體且體積為 ,由
,由 ,得
,得
 ,可見反應(yīng)前后物質(zhì)的量不變,設(shè)烷烴為
,可見反應(yīng)前后物質(zhì)的量不變,設(shè)烷烴為 ,體積為x,則CO為
,體積為x,則CO為
由 體積減少
體積減少

 體積增加
體積增加
 nL (n+1)L
nL (n+1)L 
x

據(jù)題意得: nx=
nx=
討論:(1)n=l時,x=
(2)n=2時,
(3)n=3時,
(4)n=4時,
(5)n≥5時,常溫下烷烴不是氣態(tài),所以,烷烴可能是 占50%或是:
占50%或是: 占33.3%或:
占33.3%或: 占25%
占25% w.w.w.k.s.5.u.c.o.m
w.w.w.k.s.5.u.c.o.m
30.(1)

2 mol 2 mol 2 mol 2 mol
溶液中剩余的水的質(zhì)量為:
析出小蘇打的質(zhì)量為:
(2) 和
和
當(dāng)降溫至 的質(zhì)量為:
的質(zhì)量為:

析出 的質(zhì)量為:
的質(zhì)量為:
 共析出晶體的質(zhì)量為:
共析出晶體的質(zhì)量為: www.ks5u.com
www.ks5u.com
國際學(xué)校優(yōu)選 - 練習(xí)冊列表 - 試題列表
湖北省互聯(lián)網(wǎng)違法和不良信息舉報平臺 | 網(wǎng)上有害信息舉報專區(qū) | 電信詐騙舉報專區(qū) | 涉歷史虛無主義有害信息舉報專區(qū) | 涉企侵權(quán)舉報專區(qū)
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com