
題目列表(包括答案和解析)
等物質的量的下列金屬與對應物質的量濃度的酸發生反應,則反應剛開始時,產生氫氣速率最快的是
|
編號 |
金屬(粉末狀) |
酸濃度 |
酸體積 |
反應溫度 |
|
A |
鋁Al |
18.4mol/L硫酸 |
300mL |
100℃ |
|
B |
銅Cu |
6 mol/L硝酸 |
300mL |
80℃ |
|
C |
鎂Mg |
3 mol/L硫酸 |
300mL |
50℃ |
|
D |
鋅Zn |
6 mol/L鹽酸 |
300mL |
50℃ |
| 等物質的量的下列金屬與對應物質的量濃度的酸發生反應,則反應剛開始時,產生氫氣速率最快的是 | |||||||||||||||||||||||||
|
[ ] | |||||||||||||||||||||||||
|
等物質的量的下列金屬與對應物質的量濃度的酸發生反應,則反應剛開始時,產生氫氣速率最快的是
| 編號 | 金屬(粉末狀) | 酸濃度 | 酸體積 | 反應溫度 |
| A | 鋁Al | 18.4mol/L硫酸 | 300mL | 100℃ |
| B | 銅Cu | 6 mol/L硝酸 | 300mL | 80℃ |
| C | 鎂Mg | 3 mol/L硫酸 | 300mL | 50℃ |
| D | 鋅Zn | 6 mol/L鹽酸 | 300mL | 50℃ |
Cu的化合物在生活及科研中有重要作用,不同反應可制得不同狀態的Cu2O
(1)科學研究發現納米級的Cu2O可作為太陽光分解水的催化劑。
①在加熱條件下用液態肼(N2H4)還原新制Cu(OH)2可制備納米級Cu2O,同時放出N2。當收集的N2體積為3.36L(已換算為標準狀況)時,可制備納米級Cu2O的質量為 ;
②一定溫度下,在2 L密閉容器中加入納米級Cu2O并通入0.20 mol水蒸氣,發生反應:
;測得20 min時O2的物質的量為0.0016 mol,則前20 min的反應速率v(H2O)= ;該溫度下,反應的平衡常數表達式K= ;下圖表示在t1時刻達到平衡后,只改變一個條件又達到平衡的不同時段內,H2的濃度隨時間變化的情況,則t1時平衡的移動方向為 ,t2時改變的條件可能為 ;若以K1、K2、K3分別表示t1時刻起改變條件的三個時間段內的平衡常數,t3時刻沒有加入或減少體系中的任何物質,則K1、K2、K3的關系為 ;
(2)已知:ΔH=-293kJ·mol-1
ΔH=-221kJ·mol-1
請寫出用足量炭粉還原CuO(s)制備Cu2O(s)的熱化學方程式 ;
(3)用電解法也可制備Cu2O。原理如右上圖所示,則陽極電極反應可以表示為 。
Cu的化合物在生活及科研中有重要作用,不同反應可制得不同狀態的Cu2O
(1)科學研究發現納米級的Cu2O可作為太陽光分解水的催化劑。
①在加熱條件下用液態肼(N2H4)還原新制Cu(OH)2可制備納米級Cu2O,同時放出N2。當收集的N2體積為3.36L(已換算為標準狀況)時,可制備納米級Cu2O的質量為 ;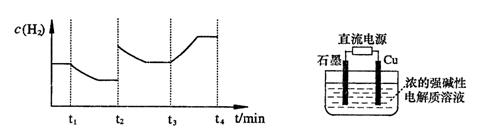
②一定 溫度下,在2 L密閉容器中加入納米級Cu2O并通入0.20 mol水蒸氣,發生反應:
溫度下,在2 L密閉容器中加入納米級Cu2O并通入0.20 mol水蒸氣,發生反應:
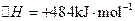 ;測得20 min時O2的物質的量為0.0016 mol,則前20 min的反應速率v(H2O)= ;該溫度下,反應的平衡常數表達式K= ;下圖表示在t1時刻達到平衡后,只改變一個條件又達到平衡的不同時段內,H2的濃度隨時間變化的情況,則t1時平衡的移動方向為 ,t2時改變的條件可能為 ;若以K1、K2、K3分別表示t1時刻起改變條件的三個時間段內的平
;測得20 min時O2的物質的量為0.0016 mol,則前20 min的反應速率v(H2O)= ;該溫度下,反應的平衡常數表達式K= ;下圖表示在t1時刻達到平衡后,只改變一個條件又達到平衡的不同時段內,H2的濃度隨時間變化的情況,則t1時平衡的移動方向為 ,t2時改變的條件可能為 ;若以K1、K2、K3分別表示t1時刻起改變條件的三個時間段內的平 衡常數,t3時刻沒有加入或減少體系中的任何物質,則K1、K2、K3的關系為 ;
衡常數,t3時刻沒有加入或減少體系中的任何物質,則K1、K2、K3的關系為 ;
(2)已知: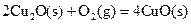 ΔH=-293kJ·mol-1
ΔH=-293kJ·mol-1 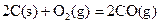 ΔH=-221kJ·mol-1
ΔH=-221kJ·mol-1
請寫出用足量炭粉還原CuO(s)制備Cu2O(s)的熱化學方程式 ;
(3)用電解法也可制備Cu2O。原理如右上圖所示,則陽極電極反應可以表示為 。
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com