
題目列表(包括答案和解析)
| 酸 | 電離方程式 | 電離平衡常數Ka |
| CH3COOH | CH3COOH?CH3COO-+H+ | 1.76×10-5 |
| H2S | H2S?H++HS- HS-?H++S2- |
Ka1=9.1×10-8 Ka2=1.1×10-12 |
| H3PO4 | H3PO4?H++H2PO4- H2PO4-?H++HPO42- HPO42-?H++PO43- |
Ka1=7.52×10-3 Ka2=6.23×10-8 Ka3=2.20×10-13 |
| C(A-).C(H+) |
| C(HA) |
| C(A-).C(H+) |
| C(HA) |
| 酸 | 電離方程式 | 電離平衡常數K |
| CH3COOH | CH3COOH?CH3COOH-+H+ | 1.76×10-5 |
| H2CO3 | H2CO3?H++HCO3- HCO3-?H++HCO32- |
K1=4.31×10-7 K2=5.61×10-11 |
| H2S | H2S?H++HS- HS-?H++S2- |
K1=9.1×10-8 K2=1.1×10-12 |
| H3PO4 | H3PO4?H++H2PO4- H2PO4-H++HPO42- HPO42-?H++PO43- |
K1=7.52×10-3 K2=6.23×10-8 K3=2.20×10-13 |
下表是幾種弱電解質的電離平衡常數、難溶電解質的溶度積Ksp(25℃)。
|
電解質 |
電離方程式 |
電離常數K |
Ksp |
|
H2CO3 |
H2CO3 HCO3- |
K1=4.31×10-7 K2=5.61×10-11 |
- |
|
C6H5OH |
C6H5OH |
1.1×10-10 |
- |
|
H3PO4 |
H3PO4 H2PO4- HPO42- |
K1=7.52×10-3 K2=6.23×10-6 K1=2.20×10-13 |
- |
|
NH3·H2O |
NH3·H2O |
1.76×10-5 |
- |
|
BaSO4 |
BaSO4(s) |
- |
1.07×10-10 |
回答下列問題:
(1)寫出C6H5OH與Na3PO4反應的離子方程式:_________________。
(2)25℃時,向10 mL 0. 01 mol/LC6H5OH溶液中滴加V mL 0.1 mol/L氨水,混合溶液中粒子濃度關系正確的是__________(填序號)。
a.若混合液pH>7,則V≥10
b.V=5時,2c(NH3·H2O)+2c(NH4+)=c(C6H5OH)+c(C6H5O-)
c.V=10時,混合液中水的電離程度小于0.01 mol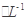 C6H5OH溶液中水的電離程度
C6H5OH溶液中水的電離程度
d.若混合液pH<7,則c(NH4+)>c(C6H5O-)>c(H+)>c(OH-)
(3)水解反應的化學平衡常數稱為水解常數(用Kb表示),類比化學平衡常數的定義。25℃時,Na2CO3第一步水解反應的水解常數Kb=____mol/L。
(4)如圖所示,有T1、T2不同溫度下兩條BaSO4在水中的沉淀溶解平衡曲線(已知BaSO4的Ksp隨溫度升高而增大)。
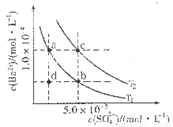
①T2____ 25℃(填“>”、“<”或“=”);
②討論T1溫度時BaSO4的沉淀溶解平衡曲線,下列說法正確的是____(填序號)。
a.加入Na2SO4不能使溶液由a點變為b點
b.在T1曲線上方區域(不含曲線)任意一點時,均有BaSO4沉淀生成
c.蒸發溶劑可能使溶液由d點變為曲線上a、b之間的某一點(不含a、b)
d.升溫可使溶液由b點變為d點
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com