
題目列表(包括答案和解析)
尋找理想的新能源和更加有效的利用已有能源是現在能源問題研究的兩個主要方向。
I.實驗測得,1g氫氣燃燒生成液態水時放出142.9kJ熱量,則氫氣燃燒的熱化學方程式為_________(填序號)。
A.2H2(g)+O2(g)=2H2O(l) △H=-142.9kJ/mol
B.H2(g)+1/2O2(g)=H2O(l) △H=-285.8kJ/mol
C.2H2+O2=2H2O(l) △H=-571.6kJ/mol
D.H2(g)+1/2O2(g)=H2O(g) △H=-142.9kJ/mol
Ⅱ.某化學家根據“原子經濟”的思想,設計了如下制備H2的反應步驟:
①CaBr2+H2O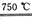 CaO+2HBr
CaO+2HBr
②2HBr+Hg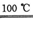 HgBr2+H2↑
HgBr2+H2↑
③HgBr2+___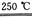 ___+___
___+___
④2HgO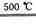 2Hg+O2↑
2Hg+O2↑
請你根據“原子經濟”的思想完成上述步驟③的化學方程式:__________________;根據“綠色化學”的思想評估該方法制H2的主要缺點:________________
Ⅲ.氫氣通常用生產水煤氣的方法制得,其中CO(g)+ H2O(g) CO2(g)+H2(g) △H<0。在850℃時,K=1。
CO2(g)+H2(g) △H<0。在850℃時,K=1。
(1)若升高溫度到950℃時,達到平衡時K____(填“大于”“小于”或“等于”)1。
(2)850℃時,若向一容積可變的密閉容器中同時充入1.0mol CO、3.0molH2O、1.0molCO和xmolH2,則:
①當x=5.0時,上述平衡向___(填“正反應” 或“逆反應”)方向進行。
②若要使上述反應開始時向正反應方向進行,則x應滿足的條件是____。
(3)在850℃時,若設x=5.0mol和x=6.0mol,其他物質的投料不變,當上述反應達到平衡后,測得H2的體積分數分別為a%、b%,則a____(填“大于”“小于”或“等于”)b。
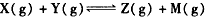 進行過程中X的轉化率隨時間變化的關系。若要改變起始條件,使反應過程按曲線b進行,可采取的措施是
進行過程中X的轉化率隨時間變化的關系。若要改變起始條件,使反應過程按曲線b進行,可采取的措施是
|
如圖曲線a表示X(g)+Y(g)
| |
A. |
升高溫度 |
B. |
加大Z的投入量 |
C. |
加催化劑 |
D. |
減小體積 |
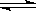 Z(g) + 2M(g) +3 N(s);?H<0 ,進行過程中X的轉化率隨時間變化的關系。若要改變起始條件,使反應過程按b曲線進行,可采取的措施是
Z(g) + 2M(g) +3 N(s);?H<0 ,進行過程中X的轉化率隨時間變化的關系。若要改變起始條件,使反應過程按b曲線進行,可采取的措施是
| A.升高溫度 | B.加大X的投入量 |
| C.擴大容器體積 | D.縮小容器體積 |
曲線a表示 2X(g) + Y(g) 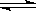 Z(g) + 2M(g) +3 N(s);?H<0 ,進行過程中X的轉化率隨時間變化的關系。若要改變起始條件,使反應過程按b曲線進行,可采取的措施是
Z(g) + 2M(g) +3 N(s);?H<0 ,進行過程中X的轉化率隨時間變化的關系。若要改變起始條件,使反應過程按b曲線進行,可采取的措施是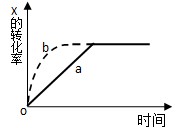
| A.升高溫度 | B.加大X的投入量 |
| C.擴大容器體積 | D.縮小容器體積 |
題號
1
2
3
4
5
6
7
8
答案
A
D
B
C
C
A
C
C
題號
9
10
11
12
13
14
15
答案
D
B
D
D
D
A
B
16.⑴ 2,4 ⑵相等,0.6 ⑶① n(D)>4/3 mol ② n(C)=3.6mol n(D) >17/15mol
⑷8∶5
17.10-14;10-12;1:9;pH(酸)+pH(堿)=13
18.⑴ 2FeSO4?7H2O Fe2O3+SO2↑+SO3↑+14H2O
Fe2O3+SO2↑+SO3↑+14H2O