
題目列表(包括答案和解析)
(1)氫化鋁鋰![]() 是一種易燃易爆還原極強的絡合氫化物還原劑,廣泛應用于化工、制藥、精細有機化工等行業。在125℃時分解為氫氣、金屬鋁及氫化鋰(LiH)。
是一種易燃易爆還原極強的絡合氫化物還原劑,廣泛應用于化工、制藥、精細有機化工等行業。在125℃時分解為氫氣、金屬鋁及氫化鋰(LiH)。
①寫出氫化鋁鋰分解反應的化學方程式:
每生成![]() 轉移電子的物質的量為
轉移電子的物質的量為
②氫化鋁鋰易水解,最初得三種產物,寫出其與水反應的化學方程式:
。
(2)在一定溫度下,向一個容積不變的容器中,通入![]() 及固體催化劑,使之反應:
及固體催化劑,使之反應:![]()
![]()
![]() 。
。
平衡時容器內氣體壓強為起始時的90%。此時:加入![]() 發生反應,達到平衡時,放出的熱量為
發生反應,達到平衡時,放出的熱量為
現有下列短周期元素性質的有關數據:
| 元素編號 | a | b | c | d | e | f | g | H |
| 原子半徑 | 0.037 | 0.071 | 0.075 | 0.082 | 0.102 | 0.143 | 0.152 | 0.186 |
| 最高價或最低價 | +1 | -1 | -3 | +3 | -2 | +3 | +1 | +1 |
(1)根據元素周期律確定a~h八種元素在周期表中的位置,將他們的元素編號填入下表相應的空格內。
| ⅠA族 | ⅡA族 | ⅢA族 | ⅣA族 | ⅤA族 | ⅥA族 | ⅦA族 | 0族 | |
| 第一周期 | ||||||||
| 第二周期 | ||||||||
| 第三周期 | ||||||||
(2)氫化鋁鋰(LiAlH4)是一種易燃、易爆具有極強還原性的物質,它在有機合成上應用廣泛。在125℃時氫化鋁鋰分解為氫氣、金屬鋁及氫化鋰(LiH)。
①氫化鋁鋰極易不解,可得三種產物,請寫出其水解的反應方程式: 。
②與氫化鋁鋰性質相似但較為溫和的還原劑由上述a、d、h三種元素組成,該還原劑的化學式是: 。
(3)一種離子化合物A由a和c兩種元素組成,兩元素的原子個數比為5:1,它的所有原子的最外層都符合相應稀有氣體原子的最外層電子結構。寫出A的電子式: 。
A物質與水反應生成一種堿和一種無色氣體,寫出有關化學方程式:
。該反應中的還原劑為: 。
(4)物質熔沸點的高低與該物質的晶體結構有關。d的單質晶體熔點為2573K,沸點為2823K,硬度大,則屬于 晶體。某同學猜想f和b的下周期同主族元素形成的化合物B晶體類型與NaCl相同,則B的熔、沸點應 (填“高于”或“低于”)NaCl。如果用實驗證明上述猜想不正確,你的實驗方案是 .
| 元素編號 | a | b | c | d | e | f | g | h | i |
| 原子半徑/nm | 0.037 | 0.064 | 0.073 | 0.070 | 0.088 | 0.102 | 0.143 | 0.152 | 0.186 |
| 最高化合價或 最低化合價 |
+1 | -1 | -2 | -3 | +3 | -2 | +3 | +1 | +1 |
| 1 |
| 3 |
| 2 |
| 3 |
| 3 |
| 2 |
| 3 |
| 2 |
鋁是最常見的金屬之一。
(1)濃硝酸、濃硫酸可貯存在鋁制容器的原因是 。
(2)納米鋁主要應用于火箭推進劑。工業上利用無水氯化鋁與氫化鋁鋰(LiAlH4)在有機溶劑中反應制得納米鋁,化學方程式如下:3LiAlH4+AlCl3="4Al" + 3LiCl + 6H2↑
該反應的氧化劑為 。
(3)氫化鋁鈉(NaAlH4)是一種重要的儲氫材料,已知:
NaAlH4(s)=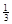 Na3AlH6 (s)+
Na3AlH6 (s)+  Al (s) + H2(g) ΔH=+ 37 kJ·molˉ1
Al (s) + H2(g) ΔH=+ 37 kJ·molˉ1
Na3AlH6(s)="3NaH(s)+"
Al (s) +  H2(g) ΔH=+ 70.5 kJ·molˉ1
H2(g) ΔH=+ 70.5 kJ·molˉ1
則NaAlH4(s)="
NaH(s)" + Al (s) + H2(g) ΔH= 。
H2(g) ΔH= 。

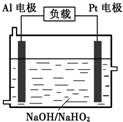
(4)已知H2O2是一種弱酸,在強堿性溶液中主要以HO2-形式存在。目前研究比較熱門的Al-H2O2燃料電池,其原理如右圖所示,電池總反應如下:
2Al+3HO2-+3H2O =2[Al(OH) 4]-+OH-
①正極反應式為 。
②與普通鋅錳干電池相比,當消耗相同質量的負極活性物質時,Al-H2O2燃料電池的理論放電量約為普通鋅錳干電池的______倍。
③Al電極易被NaOH溶液化學腐蝕,這是該電池目前未能推廣使用的原因之一。反應的離子方程式為 。
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com