
科目: 來源: 題型:
【題目】通過對實驗現象的觀察、分析推理得出正確的結論是化學學習的方法之一。對下列實驗事實的解釋正確的是
現象 | 解釋 | |
A | 用潔凈的鉑絲蘸取某溶液進行焰色反應,火焰呈黃色 | 該溶液中一定含有 |
B |
|
|
C | 某溶液中先加入稀鹽酸無現象,再加入氯化鋇溶液,有白色沉淀生成 | 該溶液中一定含有 |
D | 鐵加入稀硝酸中有氣泡產生 | 鐵與稀硝酸發生了置換反應 |
A.AB.BC.CD.D
查看答案和解析>>
科目: 來源: 題型:
【題目】粗銅精煉后的陽極泥中含有Cu、Au(金)和PbSO4等雜質,濕法處理陽極泥進行綜合利用的工藝流程如圖所示:
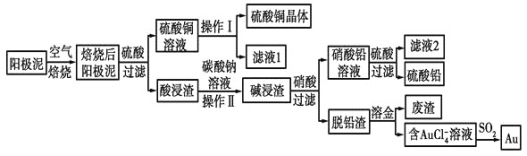
(1)電解精煉含銅、金、鉛的粗銅時,電解液應該用________溶液作電解液,電解時陽極的電極反應式為___________________________和Cu-2e-=Cu2+。
(2)完成操作Ⅰ的主要步驟有:__________________,過濾,洗滌,干燥。
(3)寫出用SO2還原AuCl4-的離子反應方程式____________________________。
(4)為了減少廢液排放、充分利用有用資源,工業上將濾液1并入硫酸銅溶液進行循環操作,請指出流程圖中另一處類似的做法________________________。
(5)用離子方程式表示加入碳酸鈉溶液的作用:___________________________。[已知298K時,Ksp(PbCO3)=1.46×10-13,Ksp(PbSO4)=1.82×10-8]。當溶液中c(SO42-)=0.2mol/L時,c(CO32-)=________mol/L。![]() 結果保留2位有效數字
結果保留2位有效數字![]()
查看答案和解析>>
科目: 來源: 題型:
【題目】現使用酸堿中和滴定法測定市售白醋的總酸量(g/100 mL)。
Ⅰ.實驗步驟:配制待測白醋溶液,用酸式滴定管量取10.00 mL食用白醋,在燒杯中用水稀釋后轉移到100 mL容量瓶中定容,搖勻即得待測白醋溶液。量取待測白醋溶液20.00mL于錐形瓶中,向其中滴加2滴酚酞作指示劑。
(1)讀取盛裝0.1000 mol/L NaOH溶液的堿式滴定管的初始讀數。如果液面位置如圖所示,則此時的讀數為________ mL。
![]()
(2)滴定。判斷滴定終點的現象是________________________________,達到滴定終點,停止滴定,并記錄NaOH溶液的最終讀數。重復滴定3次。
Ⅱ.實驗記錄:
滴定次數 實驗數據(mL) | 1 | 2 | 3 | 4 |
V(樣品) | 20.00 | 20.00 | 20.00 | 20.00 |
V(NaOH)(消耗) | 15.95 | 15.00 | 15.05 | 14.95 |
Ⅲ.數據處理與討論:
(3)某同學在處理數據時計算得:平均消耗的NaOH溶液的體積V=(15.95+15.00+15.05+14.95)/4=15.24 mL。指出他的計算的不合理之處:_________________。
(4)按正確數據處理,得出c(市售白醋)=_______mol·L-1,市售白醋總酸量=____g·100mL-1。
查看答案和解析>>
科目: 來源: 題型:
【題目】下列關于有機物的說法正確的是( )
A.含5個碳原子的有機物分子中最多可形成4個碳碳單鍵
B.蛋白質的水解和油脂的皂化都是由高分子生成小分子的過程
C.四苯基乙烯(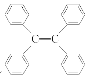 )所有碳原子一定處于同一平面
)所有碳原子一定處于同一平面
D.化學式為![]() 且有芳香氣味的有機物,在酸性條件下加熱水解產生相對分子質量相同的兩種有機物,則符合此條件的
且有芳香氣味的有機物,在酸性條件下加熱水解產生相對分子質量相同的兩種有機物,則符合此條件的![]() 的結構有16種
的結構有16種
查看答案和解析>>
科目: 來源: 題型:
【題目】化學與生活密切相關,下列說法錯誤的是( )
A.硅膠、生石灰、氯化鈣等都是食品包裝袋中常用的干燥劑
B.廁所清潔劑、食用醋、肥皂水、廚房清潔劑四種溶液的pH逐漸增大
C.酒精能使蛋白質變性,預防新冠肺炎病毒使用的酒精純度越高越好
D.使用氯氣對自來水消毒時,氯氣會與自來水中的有機物反應,生成的有機氯化物可能對人有害
查看答案和解析>>
科目: 來源: 題型:
【題目】某同學在實驗室進行鐵鹽與亞鐵鹽相互轉化的實驗:
實驗Ⅰ:將Fe3+轉化為Fe2+

(1)Fe3+與Cu粉發生反應的離子方程式為:________________________________________。
(2)探究白色沉淀產生的原因,請填寫實驗方案:
實驗方案 | 現象 | 結論 |
步驟1:取4mL_________mol/L CuSO4溶液,向其中滴加3滴0.1mol/L KSCN溶液 | 產生白色沉淀 | CuSO4與KSCN 反應產生了白色沉淀 |
步驟2:取_____________________________ | 無明顯現象 |
查閱資料:ⅰ.SCN-的化學性質與I-相似 ⅱ.2Cu2++ 4 I-= 2CuI↓+ I2
則Cu2+與SCN-反應的離子方程式為________________________________________________。
實驗Ⅱ:將Fe2+轉化為Fe3+
實驗方案 | 現象 |
向3mL 0.1mol/L FeSO4溶液中加入1 mL 8mol/L稀硝酸 | 溶液變為棕色,放置一段時間后,棕色消失,溶液變為黃色 |
探究上述現象出現的原因:
查閱資料:Fe2++ NO![]() Fe(NO)2+(棕色)
Fe(NO)2+(棕色)
(3)用離子方程式解釋NO產生的原因_______________________________________________。
(4)從化學反應速率與限度的角度對體系中存在的反應進行
反應Ⅰ:Fe2+與HNO3反應; 反應Ⅱ:Fe2+與NO反應
①依據實驗現象,甲認為反應Ⅰ的速率比反應Ⅱ__________(填“快”或“慢”)。
②乙認為反應Ⅰ是一個不可逆反應,并通過實驗證明其猜測正確,乙設計的實驗方案是______________________________。
③請用化學平衡移動原理解釋溶液由棕色變為黃色的原因__________________________________。
(5)丙認為若生成的NO與Fe2+不接觸,溶液就不會出現棕色,請從以下提供的實驗用品中選擇合適的用品,設計實驗方案,并畫出實驗裝置圖,標明試劑,實現Fe2+![]() Fe3+的轉化,同時避免出現此異常現象。
Fe3+的轉化,同時避免出現此異常現象。
實驗用品:U形管、燒杯、導線、石墨棒若干、鐵片若干、鹽橋(裝有含瓊脂的KCl飽和溶液)、 0.1mol/L FeSO4溶液、8mol/L稀硝酸

____________
查看答案和解析>>
科目: 來源: 題型:
【題目】釩被稱為“工業味精”“工業維生素”,在發展現代工業、國防等方面發揮著至關重要的作用。某高鉻型釩渣含![]() 等物質,從中分離提取釩鉻的工藝流程如下:
等物質,從中分離提取釩鉻的工藝流程如下:

回答下列問題:
(1)“焙燒”時會生成![]() 和
和![]() ,生成
,生成![]() 的化學方程式是_________________________。
的化學方程式是_________________________。
(2)濾渣1中主要含_________________。濾渣2的主要成分是![]() 和
和![]() ,要使所得濾液中含有的相關金屬離子濃度小于
,要使所得濾液中含有的相關金屬離子濃度小于![]() ,應調
,應調![]() 不低于___。(已知:
不低于___。(已知:![]()
![]()
(3)“沉釩”所用![]() 溶液中,離子濃度由大到小的順序是_________________________。
溶液中,離子濃度由大到小的順序是_________________________。
(4)“還原”時溶液的![]() 在2.5左右,此時控制酸度應選用_______________(填字母標號)。
在2.5左右,此時控制酸度應選用_______________(填字母標號)。
A.稀鹽酸 B.稀硫酸 C.稀硝酸 D.硫酸銨
(5)![]() 煅燒時發生反應的類型是否相同?____________(填“相同”或“不同”)
煅燒時發生反應的類型是否相同?____________(填“相同”或“不同”)
(6)工業上可用電解還原法處理含![]() 的酸性廢水。用鐵板作陽極,電解過程中,廢水
的酸性廢水。用鐵板作陽極,電解過程中,廢水![]() 逐漸上升
逐漸上升![]() 都以氫氧化物沉淀析出,達到廢水凈化的目的。
都以氫氧化物沉淀析出,達到廢水凈化的目的。
①其中陽極的電極反應式是_________________________。
②電解過程中,廢水![]() 上升的原因是________________________________________________。
上升的原因是________________________________________________。
查看答案和解析>>
科目: 來源: 題型:
【題目】直接排放含SO2的煙氣會形成酸雨,危害環境。工業上常采用催化還原法和堿吸收法處理SO2氣體。
(1)如圖所示:1molCH4完全燃燒生成氣態水的能量變化和1molS(g)燃燒的能量變化。
在催化劑作用下,CH4可以還原SO2生成單質S(g)、H2O(g)和CO2,寫出該反應的熱化學方程式___。
(2)焦炭催化還原二氧化硫的化學方程式為2C(s)+2SO2(g)![]() S2(g)+2CO2(g)。一定壓強下,向1L密閉容器中充入足量的焦炭和1molSO2發生反應,測得SO2的生成速率和S2(g)的生成速率隨溫度變化的關系如圖所示:
S2(g)+2CO2(g)。一定壓強下,向1L密閉容器中充入足量的焦炭和1molSO2發生反應,測得SO2的生成速率和S2(g)的生成速率隨溫度變化的關系如圖所示:

①A、B、C、D四點對應的狀態中,達到平衡狀態的有___(填字母)。
②該反應的ΔH___0(填“>”“<”或“=”)
③下列措施能夠增大SO2平衡轉化率的是___。
A.降低溫度 B.增加C的量 C.減小容器體積 D.添加高效催化劑
(3)用氨水吸收SO2。25℃時2.0mol·L-1的氨水中,NH3·H2O的電離度α=___(α=![]() ×100%)。。將含SO2的煙氣通入該氨水中,當溶液顯中性時,溶液中的
×100%)。。將含SO2的煙氣通入該氨水中,當溶液顯中性時,溶液中的![]() =___。(已知25℃,Kb(NH3·H2O)=1.8×10-5;Ka1(H2SO3)=1.3×10-2,Ka2(H2SO3)=6.2×10-8)
=___。(已知25℃,Kb(NH3·H2O)=1.8×10-5;Ka1(H2SO3)=1.3×10-2,Ka2(H2SO3)=6.2×10-8)
(4)當吸收液失去吸收能力后通入O2可得到NH4HSO4溶液,用如圖所示裝置電解所得NH4HSO4溶液可制得強氧化劑(NH4)2S2O8。
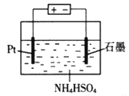
寫出電解NH4HSO4溶液的化學方程式___。
查看答案和解析>>
科目: 來源: 題型:
【題目】已知可逆反應X(g)+2Y(g)![]() 3Z(g) ΔH<0,一定溫度下,在體積為2 L的密閉容器中加入4molY和一定量的X后,X的濃度隨時間的變化情況如圖所示,則下列說法不正確的是
3Z(g) ΔH<0,一定溫度下,在體積為2 L的密閉容器中加入4molY和一定量的X后,X的濃度隨時間的變化情況如圖所示,則下列說法不正確的是
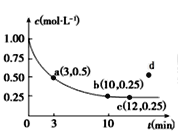
A.若向該容器中加入1molX、2molY,達平衡時,X的平衡濃度等于0.125mol/L
B.a點正反應速率大于逆反應速率
C.反應達平衡時,降低溫度不能實現c到d的轉化
D.該條件下,反應達平衡時,平衡常數K=3
查看答案和解析>>
科目: 來源: 題型:
【題目】常溫下,用0.1000mol·L-1NaOH溶液滴定20.00mL0.1000mol·L-1HA溶液所得滴定曲線如圖。下列說法不正確的是

A.HA的電離平衡常數Ka=10-5
B.點①所示的溶液中:2c(Na+)=c(A-)+c(HA)
C.點③所示的溶液中:c(HA)>c(OH-)-c(H+)
D.點④所示的溶液中:2c(OH-)-2c(H+)=c(A-)+3c(HA)
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com