
科目: 來源: 題型:
【題目】煤的氣化和液化是現代能源工業中重點考慮的綜合利用技術。最常見的氣化方法是用煤作原料生產水煤氣,而比較流行的液化方法是煤在催化劑等條件下生產CH3OH。
已知制備甲醇的有關化學反應如下:
①CO2(g)+3H2(g)CH3OH(g)+H2O(g)△H1=-90.8 kJmol-1
②CO(g)+H2O(g)CO2(g)+H2(g)△H2=-412 kJmol-1
③CO(g)+2H2(g)CH3OH(g)△H3
I.回答下列問題:
(1)欲提高甲醇的產率,可以采取的措施有______(填字母序號)。
A.升高溫度
B.增大壓強
C.降低溫度
D.降低壓強
(2)提高甲醇反應選擇性的關鍵因素是______。
(3)保持溫度和容積不變,下列描述能說明反應③達到平衡狀態的是______(填字母序號)。
A.v(CO):v(H2):v(CH3OH)=1:2:1
B.混合氣體的壓強不再隨時間的變化而變化
C.單位時間內斷裂2 mol H-H鍵,同時生成3mol C-H鍵
D.一段時間內的平均反應速率等于0
E.混合氣體的平均摩爾質量保持不變
Ⅱ.在一密閉容器中投入1mol CO和2molH2發生反應③,實驗測得平衡時甲醇的物質的量隨溫度、壓強變化關系如圖1所示:

(1)壓強P1______P2(填“>”、“<“或”=”)。
(2)M、N兩點的化學反應速率:vM______vN(填“>”、“<“或“=”)
(3)對于氣相反應,用某組分B的平衡壓強P(B)代替物質的量濃度c(B)也可表示平衡常數(Kp),則M點時,平衡常數Kp=______(P1=5 MPa)。
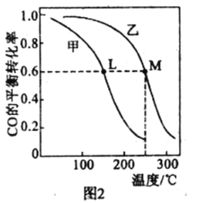
(4)甲、乙兩個恒容密閉容器的體積相同,向甲中加入 1molCO和 2mol H2,向乙中加入2mol CO和4molH2,測得不同溫度下CO的平衡轉化率如圖2所示,則L、M兩點容器內壓強:P(M)______2P(L),平衡常數:K(M)______K(L)(填“>”、“>”或“=”)。
查看答案和解析>>
科目: 來源: 題型:
【題目】已知2SO2(g)+O2(g)![]() 2SO3(g) ΔH=-197kJ·mol-1。向同溫、同體積的三個密閉容器中分別充入氣體:(甲)2molSO2和1molO2;(乙)1molSO2和0.5molO2;(丙)2mol O3。恒溫、恒容下反應達平衡時,下列關系一定正確的是( )
2SO3(g) ΔH=-197kJ·mol-1。向同溫、同體積的三個密閉容器中分別充入氣體:(甲)2molSO2和1molO2;(乙)1molSO2和0.5molO2;(丙)2mol O3。恒溫、恒容下反應達平衡時,下列關系一定正確的是( )
A.容器內壓強P:P甲=P丙>2P乙
B.反應放出或吸收熱量的數值Q:Q甲=Q丙>2Q乙
C.c(SO2)與c(O2)之比k:k甲=k丙>k乙
D.SO3的質量m:m甲=m丙>2m乙
查看答案和解析>>
科目: 來源: 題型:
【題目】鐵氰化鉀(化學式為K3[Fe(CN)6])在工業上主要應用于制藥、電鍍、造紙、鋼鐵生產,其煅燒分解生成KCN、FeC2、N2、(CN)2等物質。回答下列問題:
(1)Fe3+比Fe2+穩定的原因______。
(2)在[Fe(CN)6]3-中不存在的化學鍵為______。
A.離子鍵
B.配位鍵
C.氫鍵
D.共價鍵
(3)已知(CN)2性質與鹵素相似,化學上稱為類鹵化合物。
(CN)2+2 KOH═KCN+KCNO+H2O
KCN+HCl═HCN+KCl
C2H2+HCN→CH2=CH-C≡N
①KCNO中各元素原子的第一電離能由大到小排序為______。
②丙烯腈(CH2=CH-C≡N)分子中碳原子軌道雜化類型是______,分子中σ鍵和π鍵數目之比為______。
(4)氮化鐵晶體的晶胞結構如圖1所示,該晶體中鐵、氮的微粒個數之比為______。
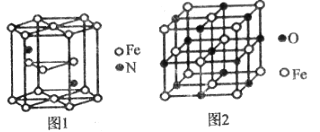
(5)已知:氧化亞鐵晶體的密度為pgcm-3,NA表示阿伏加德羅常數的值。氧化亞鐵晶體的晶胞如圖2所示,該晶胞中,與O2-緊鄰且等距離的O2-數目為______;Fe2+與O2-的最短核間距為______pm。
查看答案和解析>>
科目: 來源: 題型:
【題目】已知:2H2O(l)=2H2(g)+O2(g) ΔH=+571.0kJ/mol。以太陽能為熱源分解Fe3O4,經熱化學鐵氧化合物循環分解水制H2的過程如下:
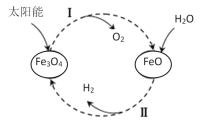
過程Ⅰ:2Fe3O4(s)=6FeO(s)+O2(g) ΔH=+313.2kJ/mol
過程Ⅱ:……
下列說法不正確的是( )
A.過程Ⅰ中每消耗232gFe3O4轉移2mol電子
B.過程Ⅱ熱化學方程式為:3FeO(s)+H2O(l)=H2(g)+Fe3O4(s) ΔH=-128.9kJ/mol
C.過程Ⅰ、Ⅱ中能量轉化的形式依次是:太陽能→化學能→熱能
D.鐵氧化合物循環制H2具有成本低、產物易分離等優點
查看答案和解析>>
科目: 來源: 題型:
【題目】已知室溫時,0.1mo1/L某一元酸HA在水中有0.1%發生電離,下列敘述錯誤的是:
A. 該溶液的pH=4 B. 升高溫度,溶液的pH增大 C. 此酸的電離平衡常數約為1×10-7 D. 由HA電離出的c(H+)約為水電離出的c(H+)的106倍
查看答案和解析>>
科目: 來源: 題型:
【題目】下列關于各圖像的解釋或結論正確的是( )
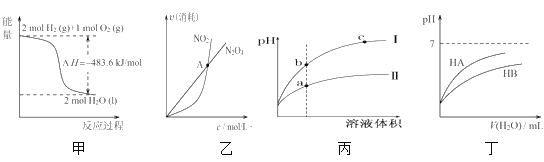
A.由甲可知:熱化學方程式是H2(g)+![]() O2(g)=H2O(g)
O2(g)=H2O(g) ![]() H=-241.8kJ/mol
H=-241.8kJ/mol
B.由乙可知:對于恒溫恒容條件下的反應2NO2(g)![]() N2O4(g),A點為平衡狀態
N2O4(g),A點為平衡狀態
C.由丙可知:相同pH的鹽酸和醋酸溶液分別加水稀釋,b點溶液的導電性比c點溶液的導電性強
D.由丁可知:同溫度、同物質的量濃度的HA溶液與HB溶液相比,其pH前者小于后者
查看答案和解析>>
科目: 來源: 題型:
【題目】I2在KI溶液中存在下列平衡:I2(aq)+I-(aq)![]() I3-(aq) ΔH。某I2、KI混合溶液中,I-的物質的量濃度c(I-)與溫度T的關系如圖所示(曲線上任何一點都表示平衡狀態)。下列說法不正確的是( )
I3-(aq) ΔH。某I2、KI混合溶液中,I-的物質的量濃度c(I-)與溫度T的關系如圖所示(曲線上任何一點都表示平衡狀態)。下列說法不正確的是( )
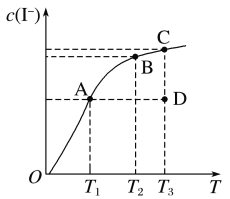
A.該反應ΔH>0
B.若反應進行到狀態D時,一定有v正>v逆
C.若在T1、T2溫度下,反應的平衡常數分別為K1、K2,則K1>K2
D.狀態A與狀態B相比,狀態A的c(I3-)大
查看答案和解析>>
科目: 來源: 題型:
【題目】根據能量變化示意圖,下列熱化學方程式正確的是( )

A. N2(g)+3H2(g)===2NH3(g) ΔH=-(b-a) kJ·mol-1
B. N2(g)+3H2(g)===2NH3(g) ΔH=-(a-b) kJ·mol-1
C. 2NH3(l)===N2(g)+3H2(g) ΔH=2(a+b-c) kJ·mol-1
D. 2NH3(l)===N2(g)+3H2(g) ΔH=2(b+c-a) kJ·mol-1
查看答案和解析>>
科目: 來源: 題型:
【題目】釩(V)為過渡元素,可形成多價態化合物,在工業催化、新材料、新能源等領域有廣泛應用。
(1)金屬釩熔點很高,可由鋁熱反應制得。
已知25℃、101 KPa時
4A1(s)+3O2(g)═2Al2O3(s)△H1=akJmol-1
4V(s)+5O2(g)═2V2O5(s)△H2=bkJmol-1
則用鋁熱反應冶煉金屬V(s)的熱化學方程式為______。
(2)全釩液流電池是一種新型的綠色環保儲能系統,工作原理如圖所示:
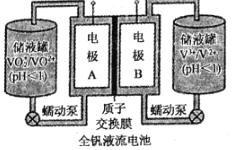
查閱相關資料可知:
離子種類 | VO2+ | VO2+ | V3+ | V2+ |
顏色 | 黃色 | 藍色 | 綠色 | 紫色 |
①該電池放電時,VO2+發生還原反應,則正極的反應式是______。
②當完成儲能時,負極溶液的顏色為______。
③電池放電時,負極區溶液的pH將______(填“增大”、“減小”或“不變”)。
④用該釩電池在鐵制品上鍍銅,鐵制品應與電池的______極(填“A“或“B“)相連。若電鍍開始時兩電極質量相等,電鍍一段時間后,兩電極質量之差為128g,此時轉移電子的物質的量為______。
查看答案和解析>>
科目: 來源: 題型:
【題目】25℃時,水的電離達到平衡:H2O![]() H++OH-,下列敘述正確的是( )
H++OH-,下列敘述正確的是( )
A.將純水加熱到95℃時,Kw變大,pH不變,水仍呈中性
B.向純水中加入稀氨水,平衡逆向移動,c(OH-)增大,Kw變小
C.向純水中加入少量Na2CO3固體,c(OH-)增大,Kw不變,影響水的電離平衡
D.向純水中加入鹽酸,可抑制水的電離;加入醋酸,可促進水的電離
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com