
科目: 來源: 題型:
【題目】羰基硫(COS)可作為一種糧食熏蒸劑,能防止某些昆蟲、線蟲和真菌的危害。在恒容密閉容器中,將CO和H2S混合加熱并達到下列平衡:CO(g)+H2S(g) ![]() COS(g)+H2(g) K=0.1,反應前CO物質的量為10mol,平衡后CO物質的量為8mol。下列說法正確的是
COS(g)+H2(g) K=0.1,反應前CO物質的量為10mol,平衡后CO物質的量為8mol。下列說法正確的是
A.CO的平衡轉化率為20%B.升高溫度,H2S濃度增加,表明該反應是吸熱反應
C.反應前H2S物質的量為8molD.通入CO后,正反應速率逐漸增大
查看答案和解析>>
科目: 來源: 題型:
【題目】三氯氫硅(SiHCl3)是制備硅烷、多晶硅的重要原料,在催化劑作用下可發生反應:2SiHCl3(g)![]() SiH2Cl2(g)+SiCl4(g),在50 ℃和70 ℃時SiHCl3的轉化率隨時間變化的結果如圖所示。下列敘述正確的是
SiH2Cl2(g)+SiCl4(g),在50 ℃和70 ℃時SiHCl3的轉化率隨時間變化的結果如圖所示。下列敘述正確的是
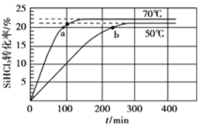
A.正反應方向為放熱反應
B.反應速率大小:va <vb
C.70 ℃時,平衡常數K =![]()
D.增大壓強,可以提高SiHCl3的平衡轉化率,縮短達平衡的時間
查看答案和解析>>
科目: 來源: 題型:
【題目】在一個固定容積的密閉容器中,可逆反應:mA(g)+nB(g) ![]() pC(g)+qD(g)中,當m、n、p、q為任意正整數時,達到平衡的標志是
pC(g)+qD(g)中,當m、n、p、q為任意正整數時,達到平衡的標志是
A.氣體分子的平均摩爾質量不再發生變化時B.各組分的物質的量濃度不再改變
C.A與C的質量分數相等D.反應速率vA∶vB∶vC∶vD=m∶n∶p∶q
查看答案和解析>>
科目: 來源: 題型:
【題目】化合物H是C5a受體拮抗劑W-54011的中間體,Nakamura等人設計制備H的合成路線如圖所示:
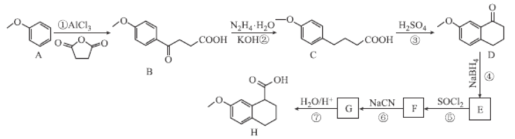
已知:Ⅰ.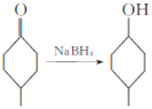 ;
;
Ⅱ.R-CN![]() R-COOH。
R-COOH。
回答下列問題:
(1)B中含氧官能團的名稱為___。
(2)F的分子式為C13H13OCl,則F的結構簡式為___。
(3)②⑤的反應類型分別為___、___。
(4)反應①的化學方程式為___。
(5)碳原子上連有4個不同的原子或基團時,該碳稱為手性碳,寫出化合物H與足量H2發生加成反應的產物的結構簡式___,并用星號(*)標出其中的手性碳:
(6)Q與C互為同分異構體,Q遇FeCl3溶液發生顯色反應,且苯環上連有兩個取代基,1molQ與足量NaHCO3溶液反應最多產生1molCO2,則Q的同分異構體有___種(不含立體異構)其中核磁共振氫譜有6組吸收峰的結構簡式為___(任寫一種)。
(7)參照上述合成路線和信息,設計以苯乙醛為原料(其它試劑任選),制備![]() 的合成路線:___。
的合成路線:___。
查看答案和解析>>
科目: 來源: 題型:
【題目】銀由于其優良的性能和特性被廣泛應用于照相、電子、電氣等工業。廢定影液中銀主要以Na3Ag(S2O3)2形式存在,實驗室用廢定影液制備Ag的具體流程如圖所示:
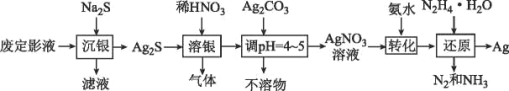
注:“還原”時由于Ag+直接與N2H4H2O反應過于激烈,所以采用加入氨水,使Ag+與氨形成[Ag(NH3)2]+,降低Ag+的濃度,從而相應降低Ag+的氧化能力,使反應能夠平穩進行。
回答下列問題:
(1)“溶銀”時產生的氣體是___(填化學式)。
(2)N2H4H2O(水合肼)為無色透明的油狀發煙液體,具有強還原性,實驗室制備原理為NaClO+2NH3=N2H4H2O+NaCl,可能用到的實驗裝置如圖所示:
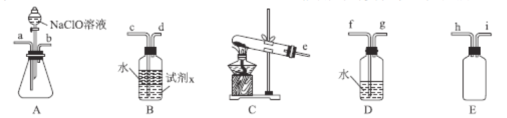
①本實驗中用不到的裝置是___。(填字母),試劑x是___(填化學式,任寫一種)。
②加入NaClO溶液時要慢慢滴加,目的是___。
③按氣流從左到右的方向,整套裝置的連接順序為___(填儀器接口小寫字母)。
(3)AgNO3見光或受熱易分解。將上述流程中AgNO3溶液蒸發濃縮可獲得AgNO3固體,實驗裝置如圖所示:
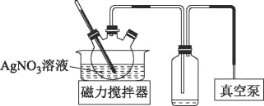
①使用真空泵的目的是___。
②測定AgNO3固體的純度(雜質不參與反應)稱取2.00g制備的AgNO3固體,加水溶解,定容到100mL;準確量取25.00mL溶液,酸化后滴入幾滴NH4Fe(SO4)2溶液作指示劑,再用0.1000molL-1NH4SCN標準溶液滴定,消耗NH4SCN標準溶液的平均體積為29.00mL,則固體中AgNO3的質量分數為___。
查看答案和解析>>
科目: 來源: 題型:
【題目】下表是25℃時弱酸的電離平衡常數,下列說法正確的是
CH3COOH | HClO | H2CO3 |
Ka=1.8×10—5 | Ka=3.0×10—8 | Ka1=4.1×10—7 Ka2=5.6×10—11 |
A.根據表中數據可知,相同濃度CH3COONa和NaClO的混合溶液中,各種離子濃度的大小關系是:c(Na+)>c(ClO﹣)>c(CH3COO﹣)>c(OH﹣)>c(H+)
B.根據表中數據可知,次氯酸鈉溶液中通入少量CO2的離子方程式為:2ClO﹣+CO2+H2O=CO32﹣+2HClO
C.向0.1mol·L-1CH3COOH溶液中加入少量水,溶液中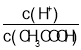 減小
減小
D.室溫下,將碳酸鈉溶液加熱至70℃,溶液的中的OH—數目增多
查看答案和解析>>
科目: 來源: 題型:
【題目】某研究性學習小組所做的石蠟油(17個碳原子以上的烷烴)分解實驗如圖所示。下列有關說法正確的是
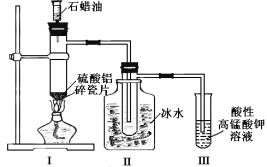
A.裝置II中逸出的氣體通入高錳酸鉀溶液,發生加成反應
B.石蠟油分解生成的氣體中只有烯烴
C.十八烷完全分解為乙烷和最多乙烯時,二者物質的量之比為1:8
D.裝置I中硫酸鋁和碎瓷片都是催化劑
查看答案和解析>>
科目: 來源: 題型:
【題目】下列有關電解質溶液的說法正確的是
A.同溫度下,CH3COONH4溶液顯中性,所以CH3COONH4不水解。
B.在室溫下稀釋兩種酸時pH變化如圖,其中HX為弱酸,且a點與b點的![]() 數值相同
數值相同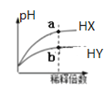
C.25℃時,等體積pH=3的HA和HB兩種酸分別與足量的鋅充分反應后,HA與Zn反應生成的氫氣更多,HA是弱酸
D.若常溫下,pH=3的HA溶液中水電離出的c(H+)為10-11mol·L-1,則能證明HA為弱酸。
查看答案和解析>>
科目: 來源: 題型:
【題目】乙炔加氫是乙烯工業中的重要精制反應,利用這一反應可以將乙烯產品中的乙炔含量降低,以避免后續乙烯聚合催化劑的中毒,工業上稱為碳二加氫過程。
已知:Ⅰ.CH![]() CH(g)+H2(g)→CH2=CH2(g) ΔH1 K1(400K)=4.2×1022
CH(g)+H2(g)→CH2=CH2(g) ΔH1 K1(400K)=4.2×1022
Ⅱ.CH![]() CH(g)+2H2(g)→CH3CH3(g) ΔH2=-311.4kJ·mol-1 K2(400K)=1.4×1038
CH(g)+2H2(g)→CH3CH3(g) ΔH2=-311.4kJ·mol-1 K2(400K)=1.4×1038
回答下列問題:
(1)已知幾種化學鍵的鍵能如下表所示:
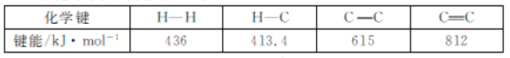
△H1=___kJmol-1。
(2)400K時,在密閉容器中將等物質的量的CH2=CH2(g)和H2(g)混合,采用適當的催化劑進行反應,生成CH3CH3(g),達到平衡時測得![]() =1016,則平衡時c(H2)=___molL-1。
=1016,則平衡時c(H2)=___molL-1。
(3)據前人研究發現乙炔在PV團簇表面催化加氫反應的部分歷程如圖1所示,其中吸附在PV表面上的物種用*標注。

推測乙烯在PV表面上的吸附為___(填“放熱”或“吸熱”)過程。圖1歷程中最大能金(活化能)E正=___kJ·mol-1,該步驟的化學方程式為___。
(4)T1℃時,將體積比為1:2的CH≡CH(g)和H2(g)充入剛性密閉容器中,加入催化劑發生反應Ⅱ,起始體系總壓強為P0 kPa,實驗測得H2的分壓(p)與反應時間(t)的關系如圖2所示。
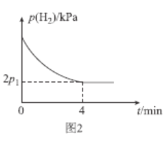
①T1℃時,0~4min內,平均反應速率v(HC≡CH)=___kPamin-1(用含p0、p1的代數式表示,下同)。
②T1℃時,該反應的化學平衡常數Kp=___kPa-2(Kp為以分壓表示的平衡常數,分壓=總壓×物質的量分數)。
③T1℃時,0~2min內p(H2)的減小量___(填“>”“<”或“=”)2~4min內p(H2)的減小量,理由為___。
查看答案和解析>>
科目: 來源: 題型:
【題目】某高分子化合物R的結構簡式如圖,下列有關R的說法正確的是
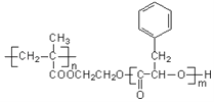
A. R的單體之一的分子式為C9H12O2
B. R可通過加聚和縮聚反應合成,R完全水解后生成2種產物
C. R是一種有特殊香味,難溶于水的物質
D. 堿性條件下,1 mol R完全水解消耗NaOH的物質 的量為n(m+1)mol
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com