
科目: 來源: 題型:
【題目】常溫下,在體積均為20mL、濃度均為0.1mol·L-1的HX溶液、HY溶液中分別滴加同濃度的NaOH溶液,反應后溶液中水電離的c(H+)表示為pH水=-lgc(H+)水。pH水與滴加氫氧化鈉溶液體積的關系如圖所示。
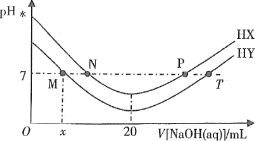
下列推斷正確的是
A.HX的電離方程式為HX=H++X-
B.T點時c(Na+)=c(Y-)>c(H+)=c(OH-)
C.常溫下用蒸餾水分別稀釋N、P點溶液,pH都降低
D.常溫下,HY的電離常數![]()
查看答案和解析>>
科目: 來源: 題型:
【題目】合成氨工業中的原料氣制取與凈化是重要的環節。
(1)已知有關反應的能量變化如圖1:寫出![]() 與
與![]() 反應制取
反應制取![]() 和
和![]() 的熱化學方程式:______。
的熱化學方程式:______。
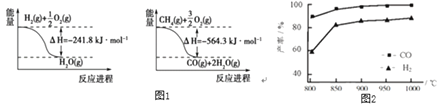
(2)“![]() 催化重整法”制氫氣:
催化重整法”制氫氣:![]() ,
,![]() 不僅可以得到合成氣
不僅可以得到合成氣![]() 和
和![]() ,還對溫室氣體的減排具有重要意義。上述反應中相關的化學鍵鍵能數據如表所示。
,還對溫室氣體的減排具有重要意義。上述反應中相關的化學鍵鍵能數據如表所示。
①根據鍵能計算,該反應的![]() ______
______![]() 。
。
化學鍵 | C-H | C=O | H-H |
|
鍵能kJ/mol | 413 | 745 | 436 | 1075 |
②按一定體積比加入![]() 和
和![]() ,在恒壓下發生反應,溫度對CO和
,在恒壓下發生反應,溫度對CO和![]() 產率的影響如圖2所示。實際生產中此反應優選溫度為900℃,原因是______。
產率的影響如圖2所示。實際生產中此反應優選溫度為900℃,原因是______。
③某溫度下,將![]() 、
、![]() 以及催化劑進行加入
以及催化劑進行加入![]() 容器中,達到平衡時
容器中,達到平衡時![]() ,平衡常數
,平衡常數![]() ______
______![]() 。
。
(3)合成氣在進入合成塔前常用醋酸二氨合銅![]() Ⅰ
Ⅰ![]() 溶液來吸收其中的CO雜質,其反應是:
溶液來吸收其中的CO雜質,其反應是:![]() ,必須除去原料氣中CO的原因是______。醋酸二氨合銅
,必須除去原料氣中CO的原因是______。醋酸二氨合銅![]() Ⅰ
Ⅰ![]() 吸收CO的生產適宜條件應是______
吸收CO的生產適宜條件應是______![]() 填序號
填序號![]() 。
。
A.高溫高壓 B.高溫低壓 C.低溫高壓 D.低溫低壓
查看答案和解析>>
科目: 來源: 題型:
【題目】電動汽車常用電池為鈷酸鋰電池,工作時原理如圖,N極材料是金屬鋰和碳的復合材料,電解質為一種能傳導Li+的固體電解質,電池反應式:
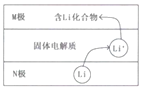
LixC6+Li1-xCoO2![]() C6+LiCoO2.下列說法錯誤的是( )
C6+LiCoO2.下列說法錯誤的是( )
A.放電時電子從N極流向M極
B.放電時N電極的反應式為:LixC6-xe-=xLi++C6
C.M極的物質具有較強還原性
D.相對于傳統鉛蓄電池,鋰電池的比能量較高
查看答案和解析>>
科目: 來源: 題型:
【題目】全世界每年鋼鐵因銹蝕造成大量的損失。某城市擬用如圖方法保護埋在酸性土壤中的鋼質管道,使其免受腐蝕。關于此方法,下列說法不正確的是( )
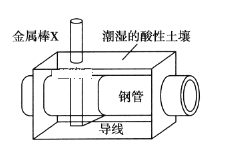
A.土壤中的鋼鐵易被腐蝕是因為在潮濕的土壤中形成了原電池
B.金屬棒X的材料應該是比鎂活潑的金屬
C.金屬棒X上發生反應:M-ne-=Mn+
D.這種方法稱為犧牲陽極的陰極保護法
查看答案和解析>>
科目: 來源: 題型:
【題目】工業上制取硝酸銨的流程圖如下,請回答下列問題:
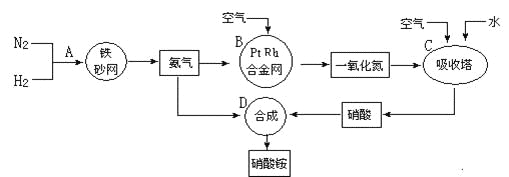
(1)在上述工業制硝酸的生產中,B設備的名稱是_____________,其中發生反應的化學方程式為________________________________________________。
(2)此生產過程中,N2與H2合成NH3所用的催化劑是______________。1909年化學家哈伯在實驗室首次合成了氨,2007年化學家格哈德·埃特爾在哈伯研究所證實了氫氣與氮氣在固體催化劑表面合成氨的反應過程,示意圖如下:
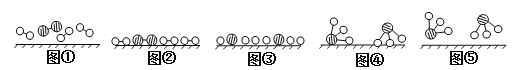
![]() 分別表示N2、H2、NH3。圖⑤表示生成的NH3離開催化劑表面,圖②和圖③的含義分別是________________、____________________。
分別表示N2、H2、NH3。圖⑤表示生成的NH3離開催化劑表面,圖②和圖③的含義分別是________________、____________________。
(3)在合成氨的設備(合成塔)中,設置熱交換器的目的是_____________________;在合成硝酸的吸收塔中通入空氣的目的是______________________________。
(4)生產硝酸的過程中常會產生一些氮的氧化物,可用如下兩種方法處理:
堿液吸收法:NO+NO2+2NaOH=2NaNO2+H2O
NH3還原法:8NH3+6NO2![]() 7N2+12H2O(NO也有類似的反應)
7N2+12H2O(NO也有類似的反應)
以上兩種方法中,符合綠色化學的是________________________________。
(5)某化肥廠用NH3制備NH4NO3。已知:由NH3制NO的產率是96%、NO制HNO3的產率是92%,則制HNO3所用去的NH3的質量占總耗NH3質量(不考慮其它損耗)的________%。
查看答案和解析>>
科目: 來源: 題型:
【題目】合成氨工業對國民經濟和社會發展具有重要意義,對于密閉容器中的反應:![]()
(1)寫出該反應的逆反應的化學平衡常數表達式______,升高溫度,該反應化學反應速率______,氫氣的轉化率______![]() 以上均填“增大”、“減小”或“不變”
以上均填“增大”、“減小”或“不變”![]() 。實際生產中溫度一般控制在
。實際生產中溫度一般控制在![]() ,原因是______。
,原因是______。
(2)能表示該反應在恒溫恒容密閉容器中![]() 時刻后已經達到平衡狀態的圖示是______。
時刻后已經達到平衡狀態的圖示是______。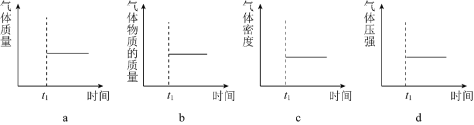
(3)濃度![]() 的氨水,pH為
的氨水,pH為![]() 當用蒸餾水稀釋100倍時,則
當用蒸餾水稀釋100倍時,則![]() 的電離平衡將向______方向移動
的電離平衡將向______方向移動![]() 填“正”或“逆”
填“正”或“逆”![]() ,溶液的pH將為______
,溶液的pH將為______![]() “大于”“小于”“等于”
“大于”“小于”“等于”![]() 。
。
設計一個簡單實驗,證明一水合氨是弱堿:______。
某化學興趣小組進行了下列關于氯化銨的課外實驗:
(實驗操作)
![]()
浸過氯化鈉溶液的布條很快燒光,浸過氯化銨溶液的布條不燃燒,冒出白煙。
(4)氯化銨飽和溶液中離子濃度由大到小的順序是______。白煙的成分是______。
(5)請推測浸過氯化銨溶液的布條不燃燒、不易著火的主要原因![]() 寫出一條即可
寫出一條即可![]() ______
______
查看答案和解析>>
科目: 來源: 題型:
【題目】亞氯酸鈉(NaC1O2)是一種重要的消毒劑,主要用于水、砂糖、油脂的漂白與殺菌。以下是制取亞氯酸鈉的工藝流程,下列說法錯誤的是( )
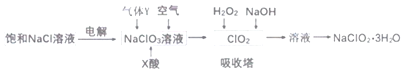
A.本工藝電解飽和氯化鈉溶液時,陽極主要產生氯氣,陰極產生氫氣
B.吸收塔內的溫度不宜過高
C.氣體Y具有還原性
D.吸收塔中發生的離子反應為:H2O2+2OH-+2C1O2=2C1O2-+O2+2H2O
查看答案和解析>>
科目: 來源: 題型:
【題目】臭氧是理想的煙氣脫硝試劑,其脫硝反應為:2NO2(g)+O3(g)N2O5(g)+O2(g),若反應在恒容密閉容器中進行,下列由該反應相關圖像作出的判斷正確的是
A | B | C | D |
|
|
|
|
t1時僅加入催化劑,平衡向正方向移動 | 達平衡時,僅改變x,則x為c(O2) | 從反應開始達平衡氣體濃度變化 | 升高溫度,平衡常數減小 |
A.AB.BC.CD.D
查看答案和解析>>
科目: 來源: 題型:
【題目】水是一種重要的自然資源,是人類賴以生存不可或缺的物質,水質優劣直接影響人體健康。海水是人類資源寶庫,若把海水淡化和化工生產結合起來,既可解決淡水資源缺乏的問題,又可充分利用海洋資源。
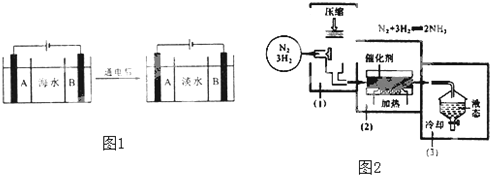
(1)天然水凈化處理過程中需要加入混凝劑,常用的混凝劑有明礬、硫酸鋁、硫酸鐵等,其凈水作用的原理是 ______。
(2)水的凈化與軟化的區別是:水的凈化是指 ______ ,而水的軟化是指 ______。
(3)目前,國際上實用的“海水淡化”主要技術之一是電滲析法,圖是利用電滲析法對海水進行淡化處理的原理圖。已知海水中含![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 等離子,電極為惰性電極。
等離子,電極為惰性電極。
①陽離子交換膜![]() 只允許陽離子通過
只允許陽離子通過![]() 是 ______
是 ______ ![]() 填“A”或“B”
填“A”或“B”![]() 。
。
②寫出通電后陽極區的電極反應式 ______ 。
(4)海水除了可以得到淡化水之外,還可提取多種化工原料.由海水制備無水氯化鎂主要有以下步驟:在一定條件下脫水干燥;加熟石灰;加鹽酸;過濾;濃縮結晶。其先后順序正確的是 ______ ![]() 填序號
填序號![]() 。
。
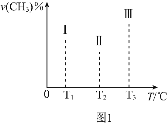
(5)海水電解制得的氫氣用于合成氨,某合成氨廠生產流程圖如圖:
①第(1)個設備中先把![]() 和
和![]() 壓縮的目的是 ______ 。
壓縮的目的是 ______ 。
②在第(3)個設備中用冷卻方法分離出 ______ ,其目的是 ______ 。
查看答案和解析>>
科目: 來源: 題型:
【題目】天然氣是一種重要的清潔能源和化工原料,其主要成分為甲烷。
I.(1)已知:一定條件下![]() 可被甲烷還原“納米級”的金屬鐵。其反應為:
可被甲烷還原“納米級”的金屬鐵。其反應為:
![]()
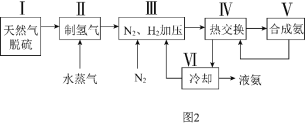
①此反應的化學平衡常數表達式為______
②在容積均為VL的I、II、III三個相同密閉容器中加入足量![]() ,然后分別充入amol
,然后分別充入amol![]() ,三個容器的反應溫度分別為
,三個容器的反應溫度分別為![]() 、
、![]() 、
、![]() 且恒定不變,在其他條件相同的情況下,實驗測得反應均進行到tmin時
且恒定不變,在其他條件相同的情況下,實驗測得反應均進行到tmin時![]() 的體積分數如圖1所示,此時I、II、III三個容器中一定處于化學平衡狀態的是______;上述反應的
的體積分數如圖1所示,此時I、II、III三個容器中一定處于化學平衡狀態的是______;上述反應的![]() ______
______![]() 填“大于”或“小于”
填“大于”或“小于”![]() ,該反應在______
,該反應在______![]() 填“高溫”、“低溫”或“任意溫度”
填“高溫”、“低溫”或“任意溫度”![]() 下可自發進行。
下可自發進行。
![]() 利用天然氣為原料的一種工業合成氨簡式流程圖如圖2:
利用天然氣為原料的一種工業合成氨簡式流程圖如圖2:
(1)步驟Ⅱ中制氫氣的原理如下:Ⅰ![]() ;
;![]()
Ⅱ![]() ;
;![]()
①對于反應Ⅰ,在一定溫度下的恒容容器中,表示其已達到最大化學反應限度的敘述正確的是______。
A.單位時間內1mol![]() 消耗,同時有3mol
消耗,同時有3mol![]() 生成;
生成;
B.![]() 、
、![]() 、CO的物質的量濃度相等;
、CO的物質的量濃度相等;
C.混合氣體的密度不再改變;
D.混合氣體的壓強不再改變。
②則反應![]() ;
;![]() ______
______![]() 用含
用含![]() 、
、![]() 的代數式表示
的代數式表示![]() 。
。
(2)合成氨是人類科學技術上的一項重大突破,反應原理為:![]() 在容積為10L的密閉容器中進行,起始時充入
在容積為10L的密閉容器中進行,起始時充入![]()
![]() 、
、![]()
![]() 反應在不同條件下進行,反應體系總壓強隨時間的變化如圖3所示。
反應在不同條件下進行,反應體系總壓強隨時間的變化如圖3所示。
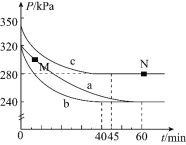
①實驗a從開始至平衡時的反應速率![]() ______;實驗c中
______;實驗c中![]() 的平衡轉化率
的平衡轉化率![]() 為______。
為______。
②與實驗a相比,其他兩組改變的實驗條件是:b______,c______。
③M點的逆反應速率![]() ______N點的正反應速率
______N點的正反應速率![]() 填“
填“![]() ”、“
”、“![]() ”或“
”或“![]() ”
”![]() ;N點時再加入一定量
;N點時再加入一定量![]() ,平衡后
,平衡后![]() 的體積分數______
的體積分數______![]() 填“增大”、“減小”或“不變”
填“增大”、“減小”或“不變”![]() 。
。
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com