
科目: 來源: 題型:
【題目】已知2A2(g)+B2(g)![]() 2C(g)ΔH=-a kJ/mol(a>0),在一個有催化劑的固定容積的容器中加入2 mol A2和1 mol B2,在500 ℃時充分反應達到平衡后C的濃度為wmol·L-1,放出熱量bkJ。
2C(g)ΔH=-a kJ/mol(a>0),在一個有催化劑的固定容積的容器中加入2 mol A2和1 mol B2,在500 ℃時充分反應達到平衡后C的濃度為wmol·L-1,放出熱量bkJ。
(1)a________b(填“>”“=”或“<”)。
(2)該反應的平衡常數表達式為________,若將反應溫度升高到700 ℃,該反應的平衡常數將________(填“增大”“減小”或“不變”)。
(3)能說明該反應已經達到平衡狀態的是________。
a.v(C)=2v(B2) b.容器內壓強保持不變 c.v逆(A2)=2v正(B2) d.容器內的密度保持不變
(4)使該反應的反應速率增大,且平衡向正反應方向移動的操作是________。
a.及時分離出C氣體 b.適當升高溫度 c.增大B2的濃度 d.選擇高效的催化劑
(5)密閉容器中,給一氧化碳和水蒸氣的氣體混合物加熱,在催化劑存在下發生反應:CO(g)+H2O(g)![]() H2(g)+CO2(g)。在500 ℃時,平衡常數K=9。若反應開始時,一氧化碳和水蒸氣的濃度都是0.02 mol/L,則在此條件下CO的轉化率為________。
H2(g)+CO2(g)。在500 ℃時,平衡常數K=9。若反應開始時,一氧化碳和水蒸氣的濃度都是0.02 mol/L,則在此條件下CO的轉化率為________。
查看答案和解析>>
科目: 來源: 題型:
【題目】電解原理在化學工業中有廣泛應用。
(1)氯堿廠電解飽和食鹽水制取燒堿,若利用下圖裝置制備NaOH,兩電極區電解液分別為NaOH和NaCl溶液。
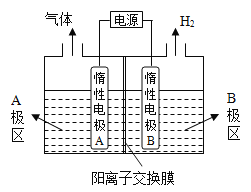
①B極區電解液為_____________溶液(填化學式),A極要連接電源的______________(填“正”或“負”)極。
②陽極電極反應式為_____________________________,電解過程中Na+向_____________電極遷移(填“A”或“B”)。
③電解總反應的離子方程式是________________________________。
(2)利用下圖裝置,可以模擬鐵的電化學防護。
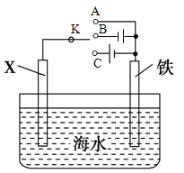
①若X為碳電極,為減緩鐵的腐蝕,開關K應置于_____________處(填“A”、“B”或“C”)。
②若X為鋅電極,開關K置于A處,該電化學防護法稱為______________________________。
查看答案和解析>>
科目: 來源: 題型:
【題目】工業上常用還原沉淀法處理含鉻廢水(![]() 和
和![]() ),其流程為:
),其流程為:
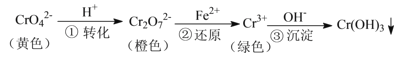
已知:步驟③生成的![]() 在溶液中存在以下沉淀溶解平衡:
在溶液中存在以下沉淀溶解平衡:![]()
![]() ,
,![]()
下列有關說法不正確的是
A.步驟①中當![]() 時,說明反應:
時,說明反應:![]() 達到平衡狀態
達到平衡狀態
B.若向![]() 溶液中加NaOH濃溶液,溶液可由橙色變黃色
溶液中加NaOH濃溶液,溶液可由橙色變黃色
C.步驟②中,若要還原![]() 離子,需要
離子,需要![]()
D.步驟③中,當將溶液的pH調節至5時,可認為廢水中的鉻元素已基本除盡![]() 當溶液中
當溶液中![]() 時,可視作該離子沉淀完全
時,可視作該離子沉淀完全![]()
查看答案和解析>>
科目: 來源: 題型:
【題目】某燒堿溶液中含有少量雜質(不與鹽酸反應),現用中和滴定測定其濃度。
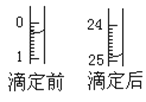
(1)用___式滴定管盛裝cmol/L鹽酸標準液。配制c mol/L鹽酸標準液,必須使用的主要容器是___。如圖表示某次滴定時50mL滴定管中前后液面的位置。滴定管讀數時應注意___。用去的標準鹽酸的體積是___mL。
(2)該實驗應選用__(填“酚酞”或者“石蕊”)作指示劑;操作中如何確定終點?__。
(3)對下列兩種假定情況進行討論:(填“無影響”、“偏高”、“偏低”)
a.若滴定前用蒸餾水沖洗錐形瓶,則會使測定結果___;
b.若在滴定過程中不慎將數滴酸液滴在錐形瓶外,則會使測定結果___;
C,讀數時,若滴定前仰視,滴定后俯視,則會使最終測定結果___。
查看答案和解析>>
科目: 來源: 題型:
【題目】蛇紋石礦可以看做是由MgO、![]() 、
、![]() 、
、![]() 組成.由蛇紋石制取堿式碳酸鎂的實驗步驟如下:
組成.由蛇紋石制取堿式碳酸鎂的實驗步驟如下:
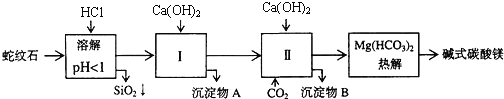
氫氧化物 |
|
|
|
開始沉淀pH |
|
|
|
(1)蛇紋石礦加鹽酸溶解后,溶液里除了![]() 外,還含有的金屬離子是 ______
外,還含有的金屬離子是 ______
(2)進行Ⅰ操作時,控制溶液![]() 有關氫氧化物沉淀的pH見上表
有關氫氧化物沉淀的pH見上表![]() 不能過量,若
不能過量,若![]() 過量可能會導致 ______ 溶解、 ______ 沉淀生成.
過量可能會導致 ______ 溶解、 ______ 沉淀生成.
(3)從沉淀混合物A中提取紅色氧化物作顏料,先向沉淀物A中加入 ______ ![]() 填入物質的化學式
填入物質的化學式![]() ,然后 ______
,然后 ______ ![]() 依次填寫實驗操作名稱
依次填寫實驗操作名稱![]() .
.
(4)物質循環使用,能節約資源.上述實驗中,可以循環使用的物質是 ______ ![]() 填寫物質化學式
填寫物質化學式![]() .
.
(5)若熱分解不完全,所得堿式碳酸鎂中將混有![]() ,則產品中鎂的質量分數 ______
,則產品中鎂的質量分數 ______ ![]() 填“升高”、“降低”或“不變”,已知碳酸鎂的相對分子質量為84,堿式碳酸鎂的相對分子質量大于
填“升高”、“降低”或“不變”,已知碳酸鎂的相對分子質量為84,堿式碳酸鎂的相對分子質量大于![]() .
.
查看答案和解析>>
科目: 來源: 題型:
【題目】到目前為止,由化學能轉變的熱能或電能仍然是人類使用的最主要的能源。
(1)在25℃、101kPa下,16g的甲醇(CH3OH)完全燃燒生成CO2和液態水時放出352kJ的熱量,則表示甲醇燃燒熱的熱化學方程式___。
(2)化學反應中放出的熱能(焓變,△H)與反應物和生成物的鍵能(E)有關。
已知:H2(g)+Cl2(g)=2HCl(g) △H=﹣185kJ/mol,
E(H﹣H)=436kJ/mol, E(Cl﹣Cl)=243kJ/mol則E(H﹣Cl)=___。
(3)①如圖是N2和H2反應生成2molNH3過程中能量變化示意圖,請計算每生成1molNH3放出熱量為:___;
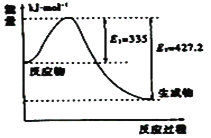
②若起始時向容器內放入1molN2和3molH2,達平衡后N2的轉化率為20%,則反應放出的熱量為Q1kJ,則Q1的數值為___;
(4)已知:Fe2O3(s)+3C(石墨)=2Fe(s)+3CO(g) ΔH=akJ·mol-1;
CO(g)+![]() O2(g)=CO2(g) ΔH=bkJ·mol-1;
O2(g)=CO2(g) ΔH=bkJ·mol-1;
C(石墨)+O2(g)=CO2(g) ΔH=ckJ·mol-1
則反應:4Fe(s)+3O2(g)=2Fe2O3(s)的焓變ΔH=___kJ·mol-1。
查看答案和解析>>
科目: 來源: 題型:
【題目】廢舊鋰離子電池的正極材料試樣![]() 主要含有
主要含有![]() 及少量Al、Fe等
及少量Al、Fe等![]() 可通過下列實驗方法回收鈷、鋰.
可通過下列實驗方法回收鈷、鋰.
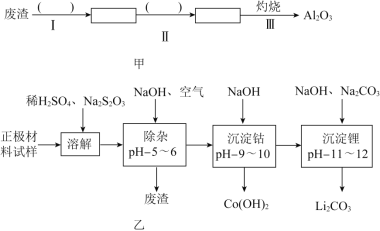
(1)在上述溶解過程中,![]() 被氧化成
被氧化成![]() ,
,![]() 在溶解過程中反應的離子方程式為 ______ .
在溶解過程中反應的離子方程式為 ______ .
沉淀物 | 開始沉淀pH | 沉淀完全pH |
|
|
|
|
|
|
|
|
|
(2)除雜時通入空氣的目的 ______ ,所得的廢渣成分為 ______ ![]() 從廢渣中獲得
從廢渣中獲得![]() 的部分流程如圖甲所示,括號表示加入的試劑,方框表示所得到的物質.則步驟I需要的玻璃儀器有 ______ ,步驟Ⅱ中反應的離子方程式是 ______ .
的部分流程如圖甲所示,括號表示加入的試劑,方框表示所得到的物質.則步驟I需要的玻璃儀器有 ______ ,步驟Ⅱ中反應的離子方程式是 ______ .
(3)工業上,將![]() 粗品制備成高純
粗品制備成高純![]() 的部分工藝如圖乙.
的部分工藝如圖乙.
![]() 將
將![]() 溶于鹽酸作電解槽的陽極液,LiOH溶液作陰極液,兩者用離子選擇透過膜隔開,用惰性電極電解.
溶于鹽酸作電解槽的陽極液,LiOH溶液作陰極液,兩者用離子選擇透過膜隔開,用惰性電極電解.
![]() 電解后向LiOH溶液中加入過量
電解后向LiOH溶液中加入過量![]() 溶液,過濾、烘干得高純
溶液,過濾、烘干得高純![]() .
.
①![]() 中,陰極的電極反應式是 ______ .
中,陰極的電極反應式是 ______ .
②![]() 中,生成
中,生成![]() 反應的化學方程式是 ______ .
反應的化學方程式是 ______ .
查看答案和解析>>
科目: 來源: 題型:
【題目】已知某溫度下CH3COOH和NH3·H2O的電離常數相等,現向10mL濃度為0.1mol·L-1的CH3COOH溶液中滴加相同濃度的氨水,在滴加過程中( )
A.水的電離程度始終增大
B.![]() 先增大再減小
先增大再減小
C.c(CH3COOH)與c(CH3COO-)之和始終保持不變
D.當加入氨水的體積為10mL時,c(NH4+)=c(CH3COO-)
查看答案和解析>>
科目: 來源: 題型:
【題目】![]() 鋁土礦
鋁土礦![]() 主要成分為
主要成分為![]() ,還含有
,還含有![]() 、
、![]() 是工業上制備氧化鋁的主要原料。工業上提取氧化鋁的工藝流程如圖:
是工業上制備氧化鋁的主要原料。工業上提取氧化鋁的工藝流程如圖:
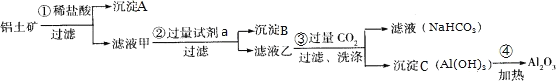
①沉淀A成分是______;步驟![]() 中的試劑a是______;
中的試劑a是______;![]() 以上均填化學式
以上均填化學式![]() ;
;
②簡述檢驗所得濾液甲中存在![]() 的操作方法:______;
的操作方法:______;
![]() 用含少量鐵的氧化銅制取氯化銅晶體
用含少量鐵的氧化銅制取氯化銅晶體![]() 。有如下操作:
。有如下操作:
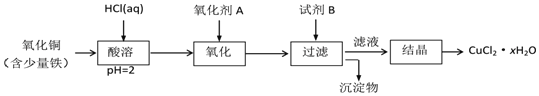
已知:在pH為![]() 時,
時,![]() 幾乎完全轉化為
幾乎完全轉化為![]() 沉淀,
沉淀,![]() 卻不反應。
卻不反應。
①氧化劑A可選用______ ![]() 填編號,下同
填編號,下同![]() ;
;
A.![]()
![]()
![]()
![]() 濃鹽酸
濃鹽酸
②試劑B可選用______;
A.NaOH ![]()
![]()
![]()
③試劑B的作用是______;
A.使![]() 完全沉淀
完全沉淀![]() 使
使![]() 完全沉淀
完全沉淀 ![]() 提高溶液的pH
提高溶液的pH ![]() 除去過量的氧化劑
除去過量的氧化劑
④從濾液經過結晶得到氯化銅晶體的方法是______。
查看答案和解析>>
科目: 來源: 題型:
【題目】有X、Y、Z、W四種含14個電子的粒子,其結構特點如下:
粒子代碼 | X | Y | Z | W |
原子核數 | 單核 | 不同元素構成的兩核 | 同元素構成的兩核 | 同元素構成的兩核 |
粒子的電荷數 | 0 | 0 | 兩個負電荷 | 0 |
![]() 原子核外比X原子多3個電子,A的原子結構示意圖是 ______ 含
原子核外比X原子多3個電子,A的原子結構示意圖是 ______ 含![]() 的氧化物晶體中含有共價鍵數目為 ______
的氧化物晶體中含有共價鍵數目為 ______
![]() 與鈣離子組成的化合物的電子式為 ______
與鈣離子組成的化合物的電子式為 ______
![]() 完全燃燒放出的熱量是
完全燃燒放出的熱量是![]() ,寫出Y燃燒的熱化學方程式 ______
,寫出Y燃燒的熱化學方程式 ______
![]() 組成W的元素最高價氧化物對應的水化物甲有如圖所示轉化關系
組成W的元素最高價氧化物對應的水化物甲有如圖所示轉化關系![]() 反應條件和其他物質已略
反應條件和其他物質已略![]()
![]()
![]() 寫出丁在高溫下與水反應的化學方程式 ______
寫出丁在高溫下與水反應的化學方程式 ______
![]() 組成W的元素的簡單氫化物極易溶于水的主要原因是 ______ ,該氫化物與空氣可以構成一種燃料電池,電解質溶液是KOH,其負極的電極反應式為 ______ 。
組成W的元素的簡單氫化物極易溶于水的主要原因是 ______ ,該氫化物與空氣可以構成一種燃料電池,電解質溶液是KOH,其負極的電極反應式為 ______ 。
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com