
科目: 來源: 題型:
【題目】373K時,某 1L密閉容器中加入2mol NH3發生如下可逆反應:2NH3(g)![]() N2(g)+3H2(g)。其中物質H2的物質的量變化如下圖所示。
N2(g)+3H2(g)。其中物質H2的物質的量變化如下圖所示。
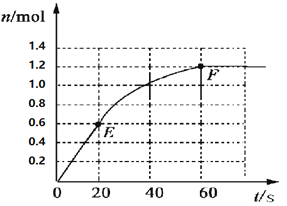
(1)前20 s內NH3(g)的平均反應速率為___________;
(2)373K時該反應的平衡常數的值為______________;
(3)若在此平衡體系中再加入1mol的NH3,與原平衡比較,新平衡時NH3的轉化率______(填“增大”或“減小”,下同),NH3的平衡濃度_________。
(4)將原平衡升溫至473K,重新達平衡時(其他條件不變),H2的平衡濃度為NH3的2倍,該反應的正反應為_________(填“放熱反應”或“吸熱反應”),為增大平衡體系中H2的物質的量,下列措施正確的是(其它條件相同)______。
a.升高溫度 b.擴大容器的體積 c.加入合適的催化劑 d.再充入N2
查看答案和解析>>
科目: 來源: 題型:
【題目】我國規定生活用水中鎘排放的最大允許濃度為0.005mg/L。處理含鎘廢水可采用化學沉淀法。試回答下列問題:
(1)磷酸鎘[Cd3(PO4)2]沉淀溶解平衡常數的表達式Ksp=___。
(2)一定溫度下,CdCO3的Ksp=4.0×10-12,Cd(OH)2的Ksp=3.2×10-14,則它們在水中的溶解能力較大的是___。
(3)在某含鎘廢水中加入Na2S,當S2-濃度達到7.9×10-8mol/L時,水體中Cd2+濃度為___mol/L,(已知:Ksp(CdS)=7.9×1027),此時是否符合水源標準?______(填“是”或“否”)。
查看答案和解析>>
科目: 來源: 題型:
【題目】CH4-CO2催化重整時發生反應:CH4(g)+CO2(g)![]() 2CO(g)+2H2(g),不僅可以得到合成氣(CO和H2),還對溫室氣體的減排具有重要意義。回答下列問題:
2CO(g)+2H2(g),不僅可以得到合成氣(CO和H2),還對溫室氣體的減排具有重要意義。回答下列問題:
(1)某溫度下,向1L的密閉容器中充入0.2molCH4與0.1molCO2,發生CH4-CO2催化重整反應,10min時達到平衡,測得平衡混合物中CO(g)的體積分數為20%,則用CH4表示的反應速率為______,CO2的平衡轉化率為______。
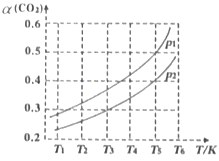
(2)若CO2的平衡轉化率(a)與溫度(T)、壓強(p)的關系如圖所示。由圖可知:壓強p1______p2(選填“>“、“<“或“=”),理由是______。
(3)在一定溫度下,向固定容積為2L的密閉容器中充入0.1moCH4與0.1mo1CO2發生CH4-CO2催化重整反應,達平衡時CO2的平衡轉化率為50%,則此條件下該反應的平衡常數為K=______;平衡后保持溫度不變,若再充入0.15molCH4、0.15molCO2、0.1molCO、0.1molH2,則此時v正______(選填“>”、“<”或“=”)v逆。
(4)已知:C(s)+2H2(g)=CH4(g)△H1=-75 kJmol-1
C(s)+O2(g)=CO2(g)△H2=-394 kJmol-1
C(s)+![]() O2(g)=CO(g)△H3=-111 kJmol-1
O2(g)=CO(g)△H3=-111 kJmol-1
①催化重整反應CH4(g)+CO2(g)![]() 2CO(g)+2H2(g)的△H=______kJmol-1。
2CO(g)+2H2(g)的△H=______kJmol-1。
②反應中催化劑活性會因積碳反應而降低,同時存在的消碳反應則使積碳量減少。相關數據如下表:
積碳反應CH4(g)=C(s)+2H2(g) | 消碳反應CO2(g)+C(s)=CO(g) | ||
△H/(kJmol-1) | 75 | 172 | |
活化能/(kJmol-1) | 催化劑X | 33 | 91 |
催化劑Y | 43 | 72 | |
由上表判斷,催化劑X______Y(填“優于”或“劣于”),理由是______。
查看答案和解析>>
科目: 來源: 題型:
【題目】AlPO4的沉淀溶解平衡曲線如圖所示(T2>T1).下列說法正確的是( )
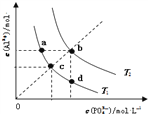
A. 圖象中四個點的Ksp:a=b>c>d
B. AlPO4在b點對應的溶解度大于c點
C. AlPO4(s)Al3+(aq)+PO43-(aq)△H<0
D. 升高溫度可使d點移動到b點
查看答案和解析>>
科目: 來源: 題型:
【題目】下列說法正確的是![]()
A.熔融狀態的![]() 不能導電,
不能導電,![]() 的稀溶液有弱的導電能力且可作手術刀的消毒液,從不同角度分類
的稀溶液有弱的導電能力且可作手術刀的消毒液,從不同角度分類![]() 是一種共價化合物、非電解質、鹽、分子晶體
是一種共價化合物、非電解質、鹽、分子晶體
B.單質熔點![]() ,是熱和電的良導體,該晶體最可能是分子晶體
,是熱和電的良導體,該晶體最可能是分子晶體
C.![]() 晶體屬于原子晶體,1mol的
晶體屬于原子晶體,1mol的![]() 晶體含有
晶體含有![]() 的
的![]() 鍵
鍵![]() 為阿伏加德羅常數
為阿伏加德羅常數![]()
D.固態金屬單質都是金屬晶體,金屬晶體含有金屬鍵,非金屬單質晶體都是分子晶體,分子晶體主要含有共價鍵和范德華力,有些分子晶體還含有氫鍵
查看答案和解析>>
科目: 來源: 題型:
【題目】某溫度下,在一個2L的密閉容器中,加入4mo1A和2molB進行如下反應:3A(g)+2B(g)![]() 4C(?)+2D(?)。反應一段時間后達到平衡,測得生成1.6molC,且反應前與反應后的氣體壓強之比為5:4(相同的溫度下測量),則下列說法正確的是( )
4C(?)+2D(?)。反應一段時間后達到平衡,測得生成1.6molC,且反應前與反應后的氣體壓強之比為5:4(相同的溫度下測量),則下列說法正確的是( )
A. 該反應的化學平衡常數表達式是![]()
B. 此時,B的平衡轉化率是20%
C. 增加C的量,B的平衡轉化率不變
D. 增大該體系的壓強,平衡向右移動,化學平衡常數增大
查看答案和解析>>
科目: 來源: 題型:
【題目】已知:25℃時,Ksp[Ni(OH)2]=2.0×10-15,Ksp[Fe(OH)3]=4.0×10-38。將含Fe2O3、Ag、Ni的某型廢催化劑溶于鹽酸,過濾,濾渣為Ag,所得溶液中c(Ni2+)=c(Fe3+)=0.4mol/L。向該溶液中滴加一定濃度的NaOH溶液(假設溶液體積不變)。下列說法中正確的是
A.金屬活動性:Ag>Ni
B.加入NaOH溶液時,先產生Ni(OH)2沉淀
C.當滴定到溶液pH=5時,溶液中lg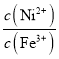 約為10
約為10
D.當滴定到溶液呈中性時,Ni2+已沉淀完全
查看答案和解析>>
科目: 來源: 題型:
【題目】我國科學家設計出一種可將光能轉化為電能和化學能的天然氣脫硫裝置,如圖,利用該裝置可實現:H2S+O2 ═H2O2 +S。已知甲池中發生轉化: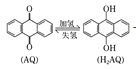 。下列說法錯誤的是
。下列說法錯誤的是
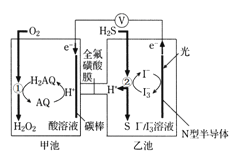
A.甲池碳棒上發生電極反應:AQ+2H++2e-=H2AQ
B.該裝置工作時,溶液中的H+從甲池經過全氟磺酸膜進入乙池
C.甲池①處發生反應:O2+H2AQ=H2O2+AQ
D.乙池②處發生反應:H2S+I3-=3I-+S↓+2H+
查看答案和解析>>
科目: 來源: 題型:
【題目】Ⅰ. 實驗室利用如右圖裝置進行中和熱的測定。回答下列問題:
(1)該圖中有一處未畫出,它是_____________(填儀器名稱)。
(2)某同學利用50 mL 0.50 mol/L的稀鹽酸與50 mL 0.55 mol/L的稀氫氧化鈉溶液進行實驗,最終測得中和熱△H=-55.2kJ/mol。已知標準中和熱為△H=-57.3kJ/mol,導致這一偏差的原因最不可能的是________(填字母序號)。
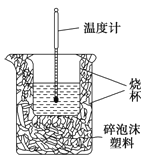
a.實驗裝置保溫、隔熱效果差
b.在量取鹽酸溶液的體積時仰視讀數
c.分多次把NaOH溶液倒入盛有稀硫酸的小燒杯中
d.用溫度計測定NaOH溶液起始溫度后直接測定鹽酸溶液的溫度
Ⅱ. 某同學用0.1000mol·L-1的標準NaOH溶液滴定未知濃度的醋酸,其操作為如下幾步。請回答:
①用蒸餾水洗滌堿式滴定管,并立即注入NaOH溶液至“0”刻度線以上
②固定好滴定管并使滴定管尖嘴充滿液體
③調節液面至“0”或“0”刻度線下,并記下讀數4.60mL
④移取20.00 mL待測液注入潔凈的錐形瓶中,并加入3滴酚酞溶液
⑤用標準液滴定至終點,記下滴定管液面讀數
(1)以上步驟有一步錯誤,該錯誤操作會導致測定結果_______(填“偏大”“偏小”或“不變”)
(2)如下圖1是某次滴定時滴定管中的終點液面,則該次測得的醋酸物質的量濃度為_____
(3)如下圖2所示為滴定圖象,a、b、c、d四點中,水的電離程度最大的是 ______點。
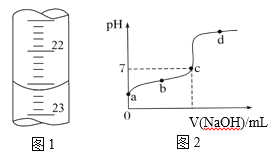
查看答案和解析>>
科目: 來源: 題型:
【題目】通過實驗得出的結論正確的是![]()
A.將固體完全溶于水,滴加稀鹽酸,出現白色沉淀,則該固體中存在![]()
B.將氣體溶于水,再滴加硝酸銀,出現白色沉淀,則該氣體為HCl
C.向某無色溶液加NaOH溶液,加熱,將濕潤的藍色石蕊試紙靠近試管口,若試紙變紅,則說明原溶液中一定含![]()
D.向某無色溶液中滴加NaOH溶液,產生白色沉淀,則該溶液中可能存在![]()
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com