
科目: 來源: 題型:實驗題
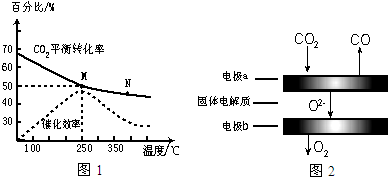
查看答案和解析>>
科目: 來源: 題型:填空題
查看答案和解析>>
科目: 來源: 題型:實驗題
| 實驗編號 | 溫度/℃ | 起始量/mol | 平衡量/mol | 達到平衡所需時間/min | ||
| SO2 | O2 | SO2 | O2 | |||
| 1 | T1 | 4 | 2 | x | 0.8 | 6 |
| 2 | T2 | 4 | 2 | 0.4 | y | 9 |
查看答案和解析>>
科目: 來源: 題型:計算題
查看答案和解析>>
科目: 來源: 題型:實驗題
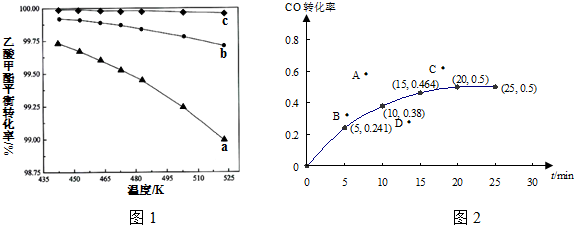
查看答案和解析>>
科目: 來源: 題型:推斷題
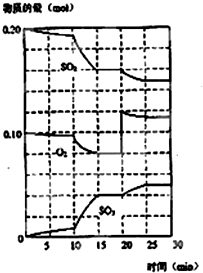 在一定條件下,二氧化硫和氧氣發(fā)生如圖反應:
在一定條件下,二氧化硫和氧氣發(fā)生如圖反應:查看答案和解析>>
科目: 來源: 題型:解答題

查看答案和解析>>
科目: 來源: 題型:解答題
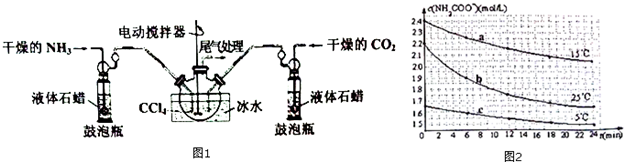
| 溫度(℃) | 20.0 | 30.0 | 40.0 |
| 平衡時氣體總濃度 (×10-3mol•L-1) | 3.4 | 4.8 | 6.8 |
查看答案和解析>>
科目: 來源: 題型:解答題
| t/min | n(CO)/mol | n(Cl2)/mol |
| 0 | 1.20 | 0.6 |
| 1 | 0.90 | |
| 2 | 0.80 | |
| 4 | 0.20 |
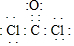
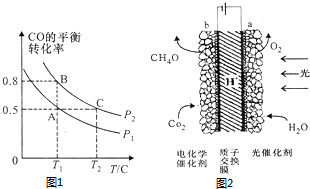
查看答案和解析>>
科目: 來源: 題型:解答題
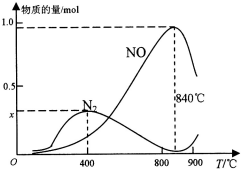 氨催化氧化是硝酸工業(yè)的基礎,按要求回答下列問題:
氨催化氧化是硝酸工業(yè)的基礎,按要求回答下列問題:| 化學鍵 | N-H |  | O-H | O=O |
| E/(kJ•mol-1) | x | y | m | n |
查看答案和解析>>
國際學校優(yōu)選 - 練習冊列表 - 試題列表
湖北省互聯(lián)網(wǎng)違法和不良信息舉報平臺 | 網(wǎng)上有害信息舉報專區(qū) | 電信詐騙舉報專區(qū) | 涉歷史虛無主義有害信息舉報專區(qū) | 涉企侵權舉報專區(qū)
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com