
科目: 來源: 題型:解答題
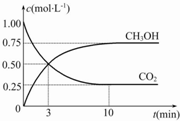 “低碳循環”引起各國的高度重視,已知煤、甲烷等可以與水蒸氣反應生成以CO和H2為主的合成氣,合成氣有廣泛應用.試回答下列問題:
“低碳循環”引起各國的高度重視,已知煤、甲烷等可以與水蒸氣反應生成以CO和H2為主的合成氣,合成氣有廣泛應用.試回答下列問題:查看答案和解析>>
科目: 來源: 題型:填空題
查看答案和解析>>
科目: 來源: 題型:解答題
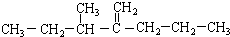 此烴名稱為3-甲基-2-丙基-1-戊烯.
此烴名稱為3-甲基-2-丙基-1-戊烯.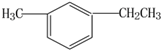 的烴可命名為-甲基-3-乙基苯.
的烴可命名為-甲基-3-乙基苯.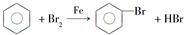 ,此反應屬于取代反應.
,此反應屬于取代反應.查看答案和解析>>
科目: 來源: 題型:解答題
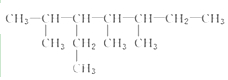 ;
;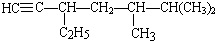 的系統名稱為5,6-二甲基-3-乙基-1-庚烯,將其在催化劑存在條件下完全氫化,所得烷烴的系統名稱為2,3-二甲基-5-乙基-庚烷.
的系統名稱為5,6-二甲基-3-乙基-1-庚烯,將其在催化劑存在條件下完全氫化,所得烷烴的系統名稱為2,3-二甲基-5-乙基-庚烷.查看答案和解析>>
科目: 來源: 題型:選擇題
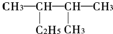 ,下列對該烷烴的系統命名中正確的是( )
,下列對該烷烴的系統命名中正確的是( )| A. | 3-甲基-2-乙基丁烷 | B. | 2-甲基-3-乙基丁烷 | ||
| C. | 2,3-二甲基戊烷 | D. | 3,4-二甲戊烷 |
查看答案和解析>>
科目: 來源: 題型:解答題
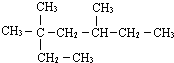 的系統命名法的名稱3,3,5,-三甲基庚烷
的系統命名法的名稱3,3,5,-三甲基庚烷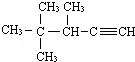 的系統命名法的名稱為3,4,4-三甲基-1-戊炔.
的系統命名法的名稱為3,4,4-三甲基-1-戊炔. .
.查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com