
科目: 來源:2015-2016學年黑龍江省高二下期中化學試卷(解析版) 題型:選擇題
下列說法正確的是( )
A.第一電離能大小:S>P>Si
B.分子晶體中,共價鍵鍵能越大,該分子晶體的熔、沸點越高
C.因為晶格能CaO比KCl高,所以KCl比CaO熔點低
D.SO2與CO2的化學性質類似,分子結構也都呈直線型,相同條件下SO2的溶解度更大
查看答案和解析>>
科目: 來源:2015-2016學年黑龍江省高二下期中化學試卷(解析版) 題型:選擇題
羰基硫(OCS)是一種有臭雞蛋氣味的無色氣體,分子結構與CO2相似,高溫下可分解為CO和S。下列有關說法正確的是( )
A.OCS、CO、CO2、S四種物質的晶體類型相同
B.OCS在高溫下分解時,碳元素化合價升高
C.OCS分子中含有2個σ鍵和2個π鍵,它們均屬于非極性鍵
D.22.4 L OCS中約含有3×6.02×1023個原子
查看答案和解析>>
科目: 來源:2015-2016學年黑龍江省高二下期中化學試卷(解析版) 題型:選擇題
三氯化氮(NCl3)是一種淡黃色的油狀液體,測得其分子具有三角錐形結構。則下面對于NCl3的描述不正確的是( )
A.它是一種極性分子 B.它的揮發性比NBr3要大
C.它還能再以配位鍵與Cl-結合 D.已知NBr3對光敏感,所以NCl3對光也敏感
查看答案和解析>>
科目: 來源:2015-2016學年黑龍江省高二下期中化學試卷(解析版) 題型:填空題
下表是元素周期表的一部分。表中所列的字母分別代表某一種化學元素。
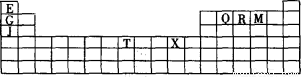
(1)寫出基態T3+的核外電子排布式: ;T在周期表中所在分區為 。
(2)Q、R、M的第一電離能由大到小的順序是 (用元素符號表示),原因 。
(3)下列有關上述元素的說法正確的是 。
A.J比X活潑,所以J可以在溶液中置換出X
B.將J2M2溶于水,要破壞離子鍵和共價鍵
C.RE3沸點高于QE4,主要是因為前者相對分子質量較大
D.一個Q2E4分子中含有五個δ鍵和一個π鍵
(4)G2O的熔點比J2O的 (填“高”或“低”) ,其原因是 。
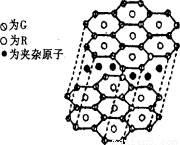
(5) G與R單質直接化合生成一種離子化合物G3R。該晶體具有類似石墨的層狀結構。每層中,G原子構成平面六邊形,每個六邊形的中心有一個R原子。層與層之間還夾雜一定數量的原子。請問這些夾雜的原子應該是 (填G或R的元素符號)。
查看答案和解析>>
科目: 來源:2015-2016學年黑龍江省高二下期中化學試卷(解析版) 題型:填空題
A~G是前四周期除稀有氣體之外原子序數依次增大的七種元素。A與其他元素既不同周期又不同族;B、C的價電子層中未成對電子數都是2;E核外的s、p能級的電子總數相等;F與E同周期且第一電離能比E小;G的+1價離子(G+)的各層電子全充滿。回答下列問題:
(1)B的核外電子有 種空間運動狀態;寫出F的外圍電子排布圖: 。
(2)根據等電子體原理,寫出B22-離子的電子式: 。
(3)根據價層電子對互斥理論(VSEPR)推測:A2C的VSEPR模型名稱: 。
(4)在測定A、D形成的化合物的相對分子質量時,實驗測定值一般高于理論值的主要原因是 。
(5)C、Si為同一主族的元素,CO2和SiO2化學式相似,但結構和性質有很大不同。CO2中C與O原子間形成 δ鍵和 π鍵。SiO2中Si與O原子間不形成上述π鍵。從原子半徑大小的角度分析,為何C、O原子間能形成,而Si、O原子間不能形成上述π鍵 。
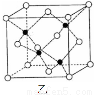
(6)E的一種晶體結構如圖甲,則其一個晶胞中含有 個E;G與D形成的化合物的晶胞結構如圖乙,若晶體密度為ag/cm3,則G與D最近的距離為 pm。(阿伏加德羅常數用NA表示,列出計算表達式,不用化簡;乙中○為G,●為D。)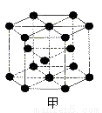
查看答案和解析>>
科目: 來源:2015-2016學年黑龍江省高二下期中化學試卷(解析版) 題型:填空題
鋰—磷酸氧銅電池正極的活性物質是Cu4O(PO4)2,可通過下列反應制備:2Na3PO4+4CuSO4+2NH3·H2O===Cu4O(PO4)2↓+3Na2SO4+(NH4)2SO4+H2O
(1)與NH3互為等電子體的分子、離子有________、________(各舉一例)。
(2)在硫酸銅溶液中加入過量KCN,生成配合物[Cu(CN)4]2-,則1 mol CN-中含有的π鍵的數目為________;若此離子與[Cu(H2O)4]2+結構相似,則此離子的空間構型為 。
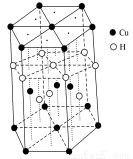
(3)Cu元素與H元素可形成一種紅色化合物,其晶體結構單元如圖所示。則該化合物的化學式為________。
(4) 甲醛(H2C=O)在Ni催化作用下加氫可得甲醇(CH3OH)。甲醇分子內的O-C-H鍵角________(填“大于”、“等于”或“小于”)甲醛分子內的O-C-H鍵角;甲醇易溶于水的原因是 。
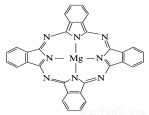
(5) 金屬酞菁配合物在硅太陽能電池中有重要作用,一種金屬鎂酞菁配合物的結構如圖所示,其中N原子的雜化方式為 ,在如圖的方框內請在圖中用箭頭表示出配位鍵。
查看答案和解析>>
科目: 來源:2015-2016學年黑龍江省高二下期中化學試卷(解析版) 題型:填空題
I.氫能的存儲是氫能應用的主要瓶頸,配位氫化物、富氫載體化合物是目前所采用的主要儲氫材料。
(1)Ti(BH4)2是一種過渡元素硼氫化物儲氫材料。在基態Ti2+中,電子占據的最高能層符號為 ,該能層具有的原子軌道數為 。
(2)液氨是富氫物質,是氫能的理想載體,利用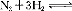 2NH3實現儲氫和輸氫。下列說法正確的是 。
2NH3實現儲氫和輸氫。下列說法正確的是 。
a.NH3分子中氮原子的軌道雜化方式為sp2雜化 b.電負性順序:C<N<O<F
c.由于氨分子間存在氫鍵,所以穩定性:NH3>PH3 d.[Cu(NH3)4]2+中N原子是配位原子
(3)已知NF3與NH3的空間構型相同,但NF3不易與Cu2+形成配離子,其原因是 。
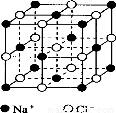
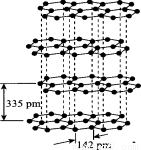
Ⅱ.氯化鈉是生活中的常用調味品,也是結構化學中研究離子晶體時常用的代表物,其晶胞結構如圖所示:
(1)設氯化鈉晶體中Na+與跟它最近鄰的Cl-之間的距離為r,則該Na+與跟它次近鄰的Cl-的個數為 ,該Na+與跟它次近鄰的Cl-之間的距離為 。
(2)已知在氯化鈉晶體中Na+的半徑為a pm,Cl-的半徑為b pm,它們在晶體中是緊密接觸的,則在氯化鈉晶體中離子的空間利用率為 (用含a、b的式子表示)。
(3)硅與碳是同主族元素,其中石墨為混合型晶體,已知石墨的層間距為335 pm,C--C鍵長為142 pm,則石墨晶體密度約為 (列式并計算,結果保留三位有效數字,NA為6.02×1023 mol-)。
查看答案和解析>>
科目: 來源:2015-2016學年黑龍江省高二下期中化學試卷(解析版) 題型:填空題
A、B、C、D、E、F、G、I均為前四周期原子序數依次增大的元素。A原子的L電子層的p能級上有一個空軌道;C的最外層有6個運動狀態不同電子;D的基態原子外圍電子排布式為3S2;E與D同周期,且在該周期中電負性最大;F、G是同族且原子序數差2的元素;I的基態原子外圍只有一個單電子。
(1) 下列關于A2H4分子和H2C2分子的說法正確的是 。
A.分子中都含有σ鍵和π鍵 B.中心原子都sp2雜化
C.都是含極性鍵和非極性鍵的非極性分子
D.互為等電子體 E.A2H4分子的沸點明顯低于H2C2分子
(2)A、B、C三種元素中的兩種,能形成原子個數比為l:3的常見微粒,推測這兩種微粒的空間構型為 。
(3)E能形成多種含氧酸,如HEO3、HEO2,請簡述酸性HEO3大于HEO2的原因: 。
(4) G與AC能形成揮發性液體G(AC)4,則其固體屬于 晶體。
(5) F常見晶體結構為體心立方堆積,原子半徑為a nm,I常見晶體結構為面心立方堆積,原子半徑為b nm,則兩種金屬的密度比為 (用含a、b的算式表示)。
(6) 已知Ti3+可形成配位數為6,顏色不同的兩種配合物晶體,一種為紫色,另一種為綠色。兩種晶體的組成皆為TiCl3·6H2O。為測定這兩種晶體的化學式,設計了如下實驗:
a.分別取等質量的兩種配合物晶體的樣品配成待測溶液;
b.分別往待測溶液中滴入AgNO3溶液,均產生白色沉淀;
c.沉淀完全后分別過濾得兩份沉淀,經洗滌干燥后稱量,發現原綠色晶體的水溶液得到的白色沉淀質量為原紫色晶體的水溶液得到的沉淀質量的2/3。則綠色晶體配合物的化學式為________________,由Cl-所形成的化學鍵類型是________。
查看答案和解析>>
科目: 來源:2015-2016學年黑龍江省高一下期中化學試卷(解析版) 題型:選擇題
下列有關化學用語使用正確的是 ( )
A.鈣離子的結構示意圖: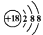 B.乙烯的結構簡式:CH2CH2
B.乙烯的結構簡式:CH2CH2
C.CH4分子的球棍模型: D.丙烯的電子式:
D.丙烯的電子式: 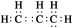
查看答案和解析>>
科目: 來源:2015-2016學年黑龍江省高一下期中化學試卷(解析版) 題型:選擇題
已知aAn+、bB(n+1)+、cCn-、dD(n+1)-是具有相同電子層結構的短周期元素形成的簡單離子。下列敘述正確的是( )
A.原子半徑:C>D>A>B B.原子序數:b>a>d>c
C.離子半徑:D>C>A>B D.單質還原性:A>B>C>D
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com