
【題目】將V1 mL1.00mol·L-1HCl溶液和V2mL未知濃度的NaOH溶液混合均勻后測量并記錄溶液溫度,實驗結果如圖所示(實驗中始終保持V1+V2=50mL,下列敘述正確的是( )
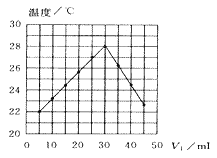
A.做該實驗時環境溫度為22℃
B.該實驗表明化學能可能轉化為熱能
C.NaOH溶液的濃度約為1.00mol·L-1
D.該實驗表明有水生成的反應都是放熱反應
科目:高中化學 來源: 題型:
【題目】(一)乙炔是一種重要的化工原料,最新研制出的由裂解氣(![]() 、
、![]() 、
、![]() )與煤粉在催化劑條件下制乙炔,已知發生的部分反應如下:
)與煤粉在催化劑條件下制乙炔,已知發生的部分反應如下:
①![]()
②![]()
③![]()
請回答:
(1)依據上述反應,則![]()
![]() ____________
____________![]()
(2)若以乙烯和氫氣的混合氣體以一定流速通過填充有催化劑的反應器(氫氣的作用是活化催化劑),出口氣中含有乙烯、乙炔、氫氣等。下圖為上述諸反應達到平衡時各氣體體積分數和反應溫度的關系曲線。

①乙炔體積分數在1530K之前隨溫度升高而增大的原因可能是______________________;1530K之后,乙炔體積分數增加不明顯的主要原因可能是_______________。
②在體積為1L的密閉容器中反應,1530K時測得氣體的總物質的量為1.000mol,則反應![]() 的平衡常數K=__________________。
的平衡常數K=__________________。
③在恒溫條件下,測得上述反應過程在相同時間時不同進料氣n(氫氣)/n(乙烯)下的乙炔產率﹐請畫出乙炔產率隨n(氫氣)/n(乙烯)的變化關系圖。
 ____________
____________
(二)乙炔―空氣燃料電池是一種堿性(20%-30%的KOH溶液)的電池,電池放電時,負極的電極方程式是________________________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】葉蟬散是一種新型殺蟲劑,防效迅速,且殘效不長,對水稻葉蟬和飛虱具有較強的觸殺作用。工業上用鄰異丙基苯酚合成葉蟬散的過程如下:

鄰異丙基苯酚 葉蟬散
下列有關說法不正確的是 ( )
A. 葉蟬散的相對分子質量為193B. 鄰異丙基苯酚分子中所有碳原子在同一個平面內
C. 葉蟬散能發生加成、水解反應D. 葉蟬散中不存在手性碳原子
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】乳酸亞鐵晶體{[CH3CH(OH)COO]2Fe·3H2O,相對分子質量為288}易溶于水,是一種很好的補鐵劑,可由乳酸[CH3 CH(OH)COOH]與FeCO3反應制得。
I.碳酸亞鐵的制備(裝置如下圖所示)

(1)儀器B的名稱是__________________;實驗操作如下:打開kl、k2,加入適量稀硫酸,關閉kl,使反應進行一段時間,其目的是__________________。
(2)接下來要使儀器C中的制備反應發生,需要進行的操作是____________,該反應產生一種常見氣體,寫出反應的離子方程式_________________________。
(3)儀器C中混合物經過濾、洗滌得到FeCO3沉淀,檢驗其是否洗凈的方法是__________。
Ⅱ.乳酸亞鐵的制備及鐵元素含量測定
(4)向純凈FeCO3固體中加入足量乳酸溶液,在75℃下攪拌使之充分反應,經過濾,在____________的條件下,經低溫蒸發等操作后,獲得乳酸亞鐵晶體。
(5)兩位同學分別用不同的方案進行鐵元素含量測定:
①甲同學通過KMnO4滴定法測定樣品中Fe2+的含量計算樣品純度。在操作均正確的前提下,所得純度總是大于l00%,其原因可能是_________________________。
②乙同學經查閱資料后改用碘量法測定鐵元素的含量計算樣品純度。稱取3.000 g樣品,灼燒完全灰化,加足量鹽酸溶解,取所有可溶物配成l00mL溶液。吸取25.00 rnL該溶液加入過量KI溶液充分反應,然后加入幾滴淀粉溶液,用0. 100 mol·L-1硫代硫酸鈉溶液滴定(已知:I2+2S2O32-=S4O62-+2I-),當溶液_____________________,即為滴定終點;平行滴定3次,硫代硫酸鈉溶液的平均用量為24.80 mL,則樣品純度為_________%(保留1位小數)。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】化合物H是合成治療心血管疾病藥物的中間體,可通過以下途徑合成:
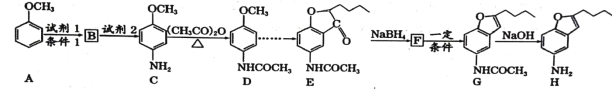
已知:①![]() (苯胺易被氧化)
(苯胺易被氧化)
②甲苯發生一硝基取代反應與A類似。
回答下列問題:
(1)寫出化合物H的分子式__________,C中含氧官能團的名稱___________。
(2)寫出有關反應類型:B![]() C ___________;F
C ___________;F![]() G___________。
G___________。
(3)寫出A![]() B的反應方程式:___________________________ 。
B的反應方程式:___________________________ 。
(4)寫出同時滿足下列條件D的所有同分異構體的結構簡式:____________
①能發生銀鏡反應
②能發生水解反應,水解產物之一與FeCl3溶液反應顯紫色
③核磁共振氫譜(1![]() 顯示分子中有4種不同化學環境的氫
顯示分子中有4種不同化學環境的氫
(5)合成途徑中,C轉化為D的目的是_____________________。
(6)參照上述合成路線,以甲苯和(CH3CO)2O為原料(無機試劑任選),設計制備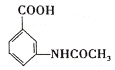 的合成路線:_________________________
的合成路線:_________________________
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列物質的轉化在給定條件下能實現的是( )
A.S![]() SO3
SO3![]() H2SO4B.Al2O3
H2SO4B.Al2O3![]() NaAlO2(aq)
NaAlO2(aq) ![]() Al(OH)3
Al(OH)3
C.SiO2 ![]() SiCl4
SiCl4![]() SiD.Fe2O3
SiD.Fe2O3![]() FeCl3(aq)
FeCl3(aq) ![]() 無水FeCl3
無水FeCl3
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】NA代表阿伏加德羅常數。已知C2H4和C3H6的混合物的質量為a g,則該混合物( )
A.所含共用電子對數目為(a/7+1) NAB.所含原子總數為aNA/14
C.燃燒時消耗的O2一定是33.6 a/14LD.所含碳氫鍵數目為aNA/7
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】在一定體積的密閉容器中進行如下化學反應:CO2(g)+H2(g)![]() CO(g)+H2O(g),其化學平衡常數(K)和溫度(t)的關系如下表所示:
CO(g)+H2O(g),其化學平衡常數(K)和溫度(t)的關系如下表所示:
t/℃ | 700 | 800 | 830 | 1 000 | 1 200 |
K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
回答下列問題:
(1)該反應的化學平衡常數表達式為K=_________________________。
(2)該反應為____________(填“吸熱”或“放熱”)反應。
(3)能判斷該反應達到化學平衡狀態的依據是________。
A.容器中壓強不變 B.混合氣體中c(CO)不變
C.υ正(H2)=υ逆(H2O) D.c(CO2)=c(CO)
(4)某溫度下,平衡濃度符合下式:c(CO2)·c(H2)=c(CO)·c(H2O),試判斷此時的溫度為________℃。
(5)在800 ℃時,發生上述反應,某一時刻測得容器內各物質的濃度分別為c(CO2)為2 mol·L-1,c(H2)為1.5 mol·L-1,c(CO)為1 mol·L-1,c(H2O)為3 mol·L-1,則下一時刻,反應向________(填“正向”或“逆向”)進行。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】常溫下,下列各組離子在指定溶液中能大量共存的是
A. 無色透明的溶液中:Fe3+、Mg2+、SCN–、Cl–
B.  =1×1012的溶液中:K+、Na +、CO32-、NO3-
=1×1012的溶液中:K+、Na +、CO32-、NO3-
C. c(Fe2+) =1mol·L1的溶液中:K+、NH4+、MnO4-、SO42-
D. 能使甲基橙變紅的溶液中:Na+、NH4+、SO42-、HCO3-
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com