
【題目】鋁的利用成為人們研究的熱點,是新型電池研發中重要的材料。
(1)通過以下反應制備金屬鋁。
反應1:Al2O3(s)+AlCl3(g)+3C(s)===3AlCl(g)+3CO(g);ΔH1=akJ·mol-1
反應2:Al2O3(s)+3C(s)===2Al(l)+3CO(g);ΔH2=bkJ·mol-1
反應3:3AlCl(g)===2Al(l)+AlCl3(g);ΔH3
①反應3的ΔH3=_______kJ·mol-1。
②950℃時,鋁土礦與足量的焦炭和Cl2反應可制得AlCl3。該反應的化學方程式是_______。
(2)在高溫條件下進行反應:2Al(l)+AlCl3(g)![]() 3AlCl(g)。
3AlCl(g)。
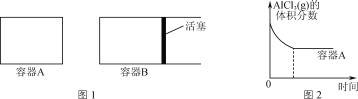
①向圖1所示的等容積A、B密閉容器中加入足量的Al粉,再分別充入1 mol AlCl3(g),在相同的高溫下進行反應。圖2表示A容器內的AlCl3(g)體積分數隨時間的變化圖,在圖2中畫出B容器內AlCl3(g)體積分數隨時間的變化曲線。__________
②1100℃時,向2 L密閉容器中通入3 mol AlCl(g),發生反應:3AlCl(g)=2Al(l)+AlCl3(g)。已知該溫度下AlCl(g)的平衡轉化率為80%,則該反應的平衡常數K=________。
③加入3molAlCl(g),在不同壓強下發生反應,溫度對產率的影響如圖3所示。此反應選擇溫度為900℃的原因是_______________。
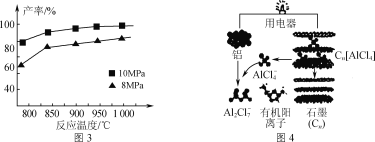
(3)用鋁制作的快速放電鋁離子二次電池的原理如圖4所示。
①該電池充電時,陰極的電極反應式為_____。
②AlCl3和NaCl的熔融鹽常用于鍍鋁電解池,電鍍時AlCl4-和Al2Cl7-兩種離子在電極上相互轉化,其他離子不參與電極反應。NaCl的作用是_____。
【答案】b-a Al2O3+3C+3Cl2![]() 2AlCl3+3CO
2AlCl3+3CO 
![]() 900℃時,產率已經較高,升高溫度產率增幅不大,但能耗升高,經濟效益降低 4Al2Cl7-+3e-===Al+7AlCl4- 生成AlCl4-和Al2Cl7-增強導電性
900℃時,產率已經較高,升高溫度產率增幅不大,但能耗升高,經濟效益降低 4Al2Cl7-+3e-===Al+7AlCl4- 生成AlCl4-和Al2Cl7-增強導電性
【解析】
(1)①已知反應①:Al2O3(s)+AlCl3(g)+3C(s)=3AlCl(g)+3CO(g);ΔH1=akJ·mol-1
反應②:Al2O3(s)+3C(s)=2Al(l)+3CO(g);ΔH2=bkJ·mol-1
反應③:3AlCl(g)=2Al(l)+AlCl3(g);ΔH3
根據蓋斯定律,由②-①得反應③3AlCl(g)=2Al(l)+AlCl3(g) ΔH3=ΔH2-ΔH1= bkJ·mol-1- akJ·mol-1= (b-a) kJ·mol-1;
②950℃時,鋁土礦與足量的焦炭和Cl2反應可制得AlCl3,同時高溫條件下生成一氧化碳,反應的化學方程式是Al2O3+3C+3Cl2![]() 2AlCl3+3CO;
2AlCl3+3CO;
(2)①向圖1所示的等容積A、B密閉容器中加入足量的Al粉,再分別充入1 mol AlCl3(g),在相同的高溫下進行反應。圖2表示A容器內的AlCl3(g)體積分數隨時間的變化圖,B容器內體積可變,正反應為氣體體積增大的反應,隨著反應的進行氣體總量增大,相對于容器A則容器B壓強減小,反應速率減慢且平衡向氣體體積增大的正反應方向移動,平衡時AlCl3(g)的體積分數減小,在圖2中畫出B容器內AlCl3(g)體積分數隨時間的變化曲線如下: ;
;
②1100℃時,向2 L密閉容器中通入3 mol AlCl(g),發生反應:3AlCl(g)=2Al(l)+AlCl3(g)。已知該溫度下AlCl(g)的平衡轉化率為80%,根據三段式有:
3AlCl(g)=2Al(l)+AlCl3(g)。
開始時濃度(mol/L)1.5 0
改變的濃度(mol/L)1.2 0.4
平衡時濃度(mol/L)0.3 0.4
則該反應的平衡常數K=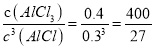 ;
;
③加入3molAlCl(g),在不同壓強下發生反應,溫度對產率的影響如圖3所示。反應選擇溫度為900℃的原因是900℃時,產率已經較高,升高溫度產率增幅不大,但能耗升高,經濟效益降低;
(3)①電池充電時,陰極上Al2Cl7-得電子產生鋁和AlCl4-,電極反應式為4Al2Cl7-+3e-===Al+7AlCl4-;
②AlCl3和NaCl的熔融鹽常用于鍍鋁電解池,電鍍時AlCl4-和Al2Cl7-兩種離子在電極上相互轉化,NaCl的作用是生成AlCl4-和Al2Cl7-增強導電性,其他離子不參與電極反應。


 尖子生新課堂課時作業系列答案
尖子生新課堂課時作業系列答案 英才計劃同步課時高效訓練系列答案
英才計劃同步課時高效訓練系列答案科目:高中化學 來源: 題型:
【題目】三種氣體X、Y、Z的相對分子質量關系為Mr(X) < Mr(Y)= 0.5Mr(Z),下列說法正確的是()
A.原子數目相等的三種氣體,質量最大的是Z
B.相同條件下,同質量的三種氣體,氣體密度最小的是X
C.若一定條件下,三種氣體體積均為2.24 L,則它們的物質的量一定均為0.1 mol
D.同溫下,體積相同的兩容器分別充2gY氣體和1gZ氣體,則其壓強比為2:1
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】根據下圖所給信息,得出的結論正確的是
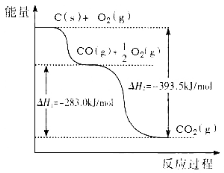
A.48g碳完全燃燒放出熱量為1574 kJ/mol
B.2C(s)+O2(g)![]() 2CO(g) △H=-221.0kJ/mol
2CO(g) △H=-221.0kJ/mol
C.2CO2(g)![]() 2CO(g)+O2(g) △H=+283.0kJ/mol
2CO(g)+O2(g) △H=+283.0kJ/mol
D.C(s)+O2(g)![]() CO2(s) △H=-393.5kJ/mol
CO2(s) △H=-393.5kJ/mol
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】已知甲、乙、丙、丁代表4種純凈物。甲(g)+2乙(g) ![]() 丙(g)+丁(g) ΔH=-a kJ·mol1 (a>0),下列說法正確的是
丙(g)+丁(g) ΔH=-a kJ·mol1 (a>0),下列說法正確的是
A. 甲(g)的能量一定大于丙(g)的能量
B. 該反應不需要加熱
C. 1 mol甲(g)與2 mol乙(g)的總能量高于1 mol丙(g)和1 mol丁(g)的總能量
D. 在一密閉容器中充入1 mol 甲(g)與2 mol 乙(g),在一定條件下反應放出的熱量為a kJ
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】金屬鋁分別和O2、O3發生反應生成Al2O3,反應過程和能量關系如下圖所示(圖中的ΔH表示生成1 mol產物的數據)。下列有關說法中不正確的是

A. Al(s)與O3(g)反應的熱化學方程式為2Al(s)+O3(g)![]() Al2O3(s) ΔH =-1559.5 kJ·mol-1
Al2O3(s) ΔH =-1559.5 kJ·mol-1
B. 等質量的O2比O3的能量低
C. 1 mol O2完全轉化為O3,需吸收142 kJ的熱量
D. 給3O2(g)![]() 2O3(g)的平衡體系加熱,有利于O3的生成
2O3(g)的平衡體系加熱,有利于O3的生成
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】配制![]() 溶液。回答下列問題:
溶液。回答下列問題:
(1)需要固體NaCl________g。
(2)配制操作中,一定用不到的玻璃儀器是________![]() 填選項字母
填選項字母![]() 。還缺少的玻璃儀器是________。
。還缺少的玻璃儀器是________。
A.燒杯 ![]() 膠頭滴管
膠頭滴管 ![]() 玻璃棒
玻璃棒 ![]() 分液漏斗
分液漏斗
(3)若容量瓶中有少量蒸餾水,所配溶液的濃度將________![]() 填“偏大”、“偏小”或“無影響”,下同
填“偏大”、“偏小”或“無影響”,下同![]() ;若定容時仰視加水至刻度線,所配溶液的濃度將________。
;若定容時仰視加水至刻度線,所配溶液的濃度將________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】錳元素的化合物在多個領域中均有重要應用。
(1)Mn2+基態核外電子排布式為________,SO42-中S原子軌道的雜化類型為________。
(2)二價錳的3種離子化合物的熔點如下表:
物質 | MnCl2 | MnS | MnO |
熔點 | 650℃ | 1610℃ | 2800℃ |
上表3種物質中晶格能最大的是________。
(3)某錳氧化物的晶胞結構如圖所示,該氧化物的化學式為________。
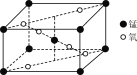
(4)在化合物K3[Mn(CN)6]中,微粒之間存在的作用力有________(填字母)。
a. 離子鍵 b. 共價鍵 c. 配位鍵 d. 氫鍵
(5)制備LiMn2O4的實驗過程如下:將MnO2和Li2CO3按4∶1的物質的量之比配料,球磨3~5 h,然后升溫,高溫加熱,保溫24 h,冷卻至室溫。寫出該反應的化學方程式:____________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】用下列實驗裝置(部分夾持裝置略去)進行相應的實驗,能達到實驗目的的是
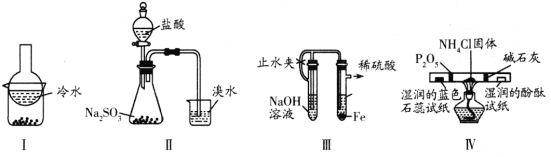
A. 加熱裝置Ⅰ中的燒杯分離I2和高錳酸鉀固體
B. 用裝置Ⅱ驗證二氧化硫的漂白性
C. 用裝置Ⅲ制備氫氧化亞鐵沉淀
D. 用裝置Ⅳ檢驗氯化銨受熱分解生成的兩種氣體
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】某課外小組分別用下圖所示裝置對原電池和電解原理進行實驗探究。

請回答:
I.用圖1所示裝置進行第一組實驗。
(1)在保證電極反應不變的情況下,不能替代Cu做電極的是_________(填字母序號)。
A.鋁 | B.石墨 | C.銀 | D.鉑 |
(2)N極發生反應的電極反應式為____________________。
(3)實驗過程中,SO42-_________(填“從左向右”、“從右向左”或“不”)移動;
濾紙上能觀察到的現象有___________________。
II.用圖2所示裝置進行第二組實驗。實驗過程中,兩極均有氣體產生,Y極區溶液逐漸變成紫紅色;停止實驗,鐵電極明顯變細,電解液仍然澄清。查閱資料發現,高鐵酸根(FeO42-)在溶液中呈紫紅色。
(4)電解過程中,X極區溶液的pH___________(填“增大” 、“減小”或“不變”)。電解過程中,Y極發生的電極反應為Fe-6e-+8OH-=FeO42-+4H2O 和_______________。
(5)若在X極收集到672 mL氣體,在Y極收集到168 mL氣體(均已折算為標準狀況時氣體體積),則Y電極(鐵電極)質量減少________g。
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com