
【題目】實驗室用MnO2和濃鹽酸制氯氣的反應為MnO2+4HCl(濃)![]() MnCl2+2H2O+Cl2↑。反應中,如果有17.4 g純MnO2被還原,那么:
MnCl2+2H2O+Cl2↑。反應中,如果有17.4 g純MnO2被還原,那么:
(1)被氧化的氯化氫的質量為________________________________________________。
(2)轉移電子的物質的量為________________________________________________。
(3)紡織工業中常用氯氣作漂白劑,漂白布匹后,過量的氯需要除去,通常可用Na2SO3作“脫氯劑”,脫氯后的產物為Na2SO4,氯變為-1價。若把本題中產生的Cl2完全轉化,需要Na2SO3的質量為_________。
【答案】14.6 g 0.4 mol 25.2 g
【解析】
(1)消耗二氧化錳的物質的量是17.4g÷87g/mol=0.2mol,則根據方程式可知
MnO2+4HCl(濃)![]() MnCl2+2H2O+Cl2↑ 被氧化HCl
MnCl2+2H2O+Cl2↑ 被氧化HCl
1mol 2mol
0.2mol 0.4mol
所以被氧化的氯化氫的質量為0.4mol×36.5g/mol=14.6g;
(2)反應中氯元素化合價從-1價升高到0價,失去1個電子,這說明每氧化1mol氯化氫轉移1mol電子,所以轉移電子的物質的量為0.4mol;
(3)被氧化的氯化氫的物質的量是0.4mol,生成氯氣是0.2mol。氯氣與亞硫酸鈉反應生成硫酸鈉和氯化鈉,反應中亞硫酸鈉中的S化合價升高,氯氣中Cl化合價降低,設需要Na2SO3的物質的量是x,根據電子守恒可知x×(6-4)=0.2mol×2×(1-0),解得x=0.2mol,因此需要Na2SO3的質量是0.2mol×126g/mol=25.2g。


 名校課堂系列答案
名校課堂系列答案科目:高中化學 來源: 題型:
【題目】t℃時,某NaOH稀溶液中,c(H+)=10-amol/L,c(OH-)=10-bmol/L,已知a+b=12。
(1)該溫度下,水的離子積常數Kw=________________。
(2)在該溫度下,將100mL0.1mol/L的稀硫酸與100mL0.4mol/L的NaOH溶液混合后,溶液的pH=_________,此時該溶液中由水電離的c(OH-)=____________。
(3)該溫度下,若100體積pH1=a的某強酸溶液與1體積pH2=b的某強堿溶液混合后溶液呈中性,則混合前,該強酸的pH1與強堿的pH2之間應滿足的關系是______________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】為了強化安全管理,某油庫引進了一臺空氣中汽油含量的測量儀,其工作原理如圖所示 (用強酸性溶液作電解質溶液)。下列說法中不正確的是
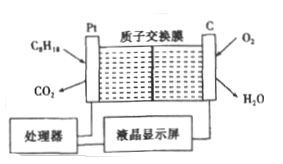
A. 石量電極作正極,電極表面有物質被還原
B. 鉑電極的電極反應式為: C8H18+16H2O-50e-=8CO2+50H+
C. H+由質子交換膜左側向右側遷移
D. 標況下每消耗5.6 L O2電路中通過1mol 電子,經過電解質形成閉合回路
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列離子方程式書寫正確的是( )
A. 硫酸鐵中加入少量氨水:Fe3++3OH-=Fe(OH)3↓
B. 電解飽和食鹽水:2Cl-+2H2O![]() H2↑+Cl2↑+2OH-
H2↑+Cl2↑+2OH-
C. 碳酸鈣與鹽酸反應:CO32-+2H+=CO2↑+H2O
D. 將鋁投入CuSO4溶液中:Al+Cu2+=Cu+Al3+
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】某學生設計如下圖所示的實驗裝置,利用氯氣與潮濕的消石灰反應制取少量漂白粉(這是一個放熱反應)。回答下列問題:
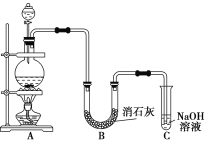
(1)在A裝置中用固體二氧化錳與濃鹽酸在加熱條件下制取氯氣,寫出反應的化學方程式并用雙線橋法表示出反應中電子轉移的方向和數目_____________________;若在標準狀況下收集到22.4 L氯氣,則被氧化的HCl的物質的量是______。
(2)漂白粉將在U形管中產生,其化學方程式是______________。
(3)C裝置的作用是_______________________________________。
(4)此實驗所得漂白粉的有效成分偏低,該學生經分析并查閱資料發現,主要原因是在U形管中還存在兩個副反應。
①溫度較高時氯氣與消石灰反應生成Ca(ClO3)2,為避免此副反應的發生,可采取的措施是______________________________________________________________。
②試判斷另一個副反應__________________________________(用化學方程式表示)。為避免此副反應的發生,可將裝置做何改進________________________________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列判斷中一定正確的是( )
A. NaCl及Na2O2固體中陰、陽離子數之比均為1:1
B. 等質量的O2與O3中,氧原子的個數比為3:2
C. 分別用H2O2、KMnO4分解制O2,當制得等質量O2時,轉移電子數之比為1:2
D. 10 mL 0.3 mol·L-1 NaCl溶液與30 mL 0.1 mol·L-1 AlCl3溶液中Cl -物質的量濃度比為1:3
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】某溫度下,相同pH的鹽酸和醋酸溶液分別加水稀釋,pH隨溶液體積變化的曲線如右圖所示。據圖判斷正確的是
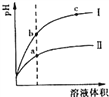
A. Ⅱ為鹽酸稀釋時的pH值變化曲線
B. b點溶液的導電性比c點溶液的導電性強
C. a點KW的數值比c點KW的數值大
D. b點酸的總濃度大于a點酸的總濃度
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com