
【題目】為探究氧化銅與硫的反應并分析反應后的固體產物,設計如下實驗裝置。
(1)如圖連接實驗裝置,并_____。
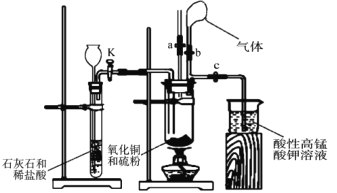
(2)將氧化銅粉末與硫粉按 5:1 質量比混合均勻。
(3)取適量氧化銅與硫粉的混合物裝入大試管中,固定在鐵架臺上,打開_____ 和止水夾 a 并______,向長頸漏斗中加入稀鹽酸,一段時間后,將燃著的木條放在止水夾 a 的上端導管口處,觀察到木條熄滅,關閉活塞 K 和止水夾 a,打開止水夾 b。該實驗步驟的作用是______,石灰石與稀鹽酸反應的離子方程式為___________________。
(4)點燃酒精燈,預熱大試管,然后對準大試管底部集中加熱,一段時間后,氣球膨脹, 移除酒精燈,反應繼續進行。待反應結束,發現氣球沒有變小,打開止水夾 c,觀察到酸性高錳酸鉀溶液褪色后,立即用盛有氫氧化鈉溶液的燒杯替換盛裝酸性高錳酸鉀溶液的燒杯,并打開活塞 K。這樣操作的目的是__________________。
(5)拆下裝置,發現黑色粉末混有磚紅色粉末。取少量固體產物投入足量氨水中,得到無色溶液、但仍有紅黑色固體未溶解,且該無色溶液在空氣中逐漸變為藍色。查閱資料得知溶液顏色變化是因為發生了以下反應:4[Cu(NH3)2]+ + O2+8NH3 H2O=4[Cu(NH3)4]2++4OH-+6H2O。
①經分析,固體產物中含有Cu2O。Cu2O 溶于氨水反應的離子方程式為______。
②仍有紅色固體未溶解,表明氧化銅與硫除發生反應 4CuO + S![]() 2Cu2O+SO2外,還一定發生了其他反應,其化學方程式為_________。
2Cu2O+SO2外,還一定發生了其他反應,其化學方程式為_________。
③進一步分析發現 CuO 已完全反應,不溶于氨水的黑色固體可能是_____(填化學式)。
【答案】檢查裝置氣密性 活塞K 關閉 b、c 排除裝置中的空氣或氧氣 CaCO3 +2H+ =Ca2++ H2O+CO2↑ 避免SO2污染空氣 Cu2O+4NH3 · H2O =2[Cu(NH3)2]++2OH-+3H2O 2CuO+S![]() 2Cu+SO2 Cu2S
2Cu+SO2 Cu2S
【解析】
(1)硫在加熱條件下易于空氣中的氧氣反應,對該實驗會產生影響,要確保實驗裝置中無空氣,保證密閉環境;
(3)氧化銅與硫的反應,需在無氧條件下進行,石灰石與鹽酸反應產生的CO2氣體排除裝置中的空氣;
(4)酸性高錳酸鉀溶液褪色,說明產物有SO2,二氧化硫有毒不能排放到大氣中;
(5)反應剩余固體含有Cu2O(磚紅色),加入氨水后但仍有紅黑色固體未溶解,表明有Cu,CuO與S的質量比為5∶1。而生成Cu2O的反應方程式為4CuO+ S![]() 2Cu2O+SO2,其中CuO與S的質量比為10∶1,因此S過量。
2Cu2O+SO2,其中CuO與S的質量比為10∶1,因此S過量。
(1)探究氧化銅與硫的反應,需在無氧條件下進行(S在空氣與O2反應),故需對裝置進行氣密性檢查;
(3)利用石灰石與鹽酸反應產生的CO2氣體排除裝置中的空氣,打開K使鹽酸與石灰石接觸,打開a,并檢驗是否排盡空氣,該實驗步驟的作用是排除裝置中的空氣或氧氣。石灰石與鹽酸反應的離子方程式是CaCO3+2H+=Ca2++ H2O+CO2↑;
(4)酸性高錳酸鉀溶液褪色,說明產物有SO2,用盛有氫氧化鈉溶液的燒杯替換盛裝酸性高錳酸鉀溶液的燒杯,并打開活塞K的目的是盡量使SO2被吸收,避免污染環境;
(5)結合題意,反應剩余固體含有Cu2O(磚紅色),因為Cu2O與氨水反應為Cu2O+4NH3·H2O=2[Cu(NH3)2]+(無色)+2OH-+ 3H2O,4[Cu(NH3)2]++O2+8NH3·H2O=4 [Cu(NH3)4]2+(藍色)+4OH-+6H2O。但仍有紅黑色固體未溶解,表明有Cu,反應方程式為2CuO+S![]() 2Cu+SO2,其中CuO與S的質量比為5∶1。而生成Cu2O的反應方程式為4CuO+ S
2Cu+SO2,其中CuO與S的質量比為5∶1。而生成Cu2O的反應方程式為4CuO+ S![]() 2Cu2O+SO2,其中CuO與S的質量比為10∶1,因此S過量,則可能發生反應2Cu+S
2Cu2O+SO2,其中CuO與S的質量比為10∶1,因此S過量,則可能發生反應2Cu+S![]() Cu2S,黑色固體為Cu2S。
Cu2S,黑色固體為Cu2S。


 閱讀快車系列答案
閱讀快車系列答案科目:高中化學 來源: 題型:
【題目】T℃時,在一個體積為2L的容器中,A氣體與B氣體反應生成C氣體,反應過程中A、B、C變化如圖所示。
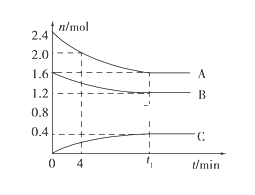
(1)寫出該反應的化學方程式:___________;
(2)該溫度下該反應的平衡常數為(保留兩位有效數字)_______;
(3)已知:K(300℃)>K(350℃),該反應是________熱反應;
(4)0~4分鐘時,A的平均反應速率為____________;
(5)到達平衡時B的轉化率為____________;
(6)恒容條件下,下列措施中能使![]() 降低的有__________。
降低的有__________。
A 充入氦氣 B 使用催化劑
C 再充入2.4mol A和1.6mol B D 降低溫度
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】某科研團隊研究將磷鎢酸(H3PW12O40,以下簡稱HPW)代替濃硫酸作為酯化反應的催化劑,但HPW自身存在比表面積小、易溶于有機溶劑而難以重復使用等缺點,將其負載在多孔載體(如硅藻土、C等)上則能有效克服以上不足,提高其催化活性。用HPW負載在硅藻土上催化制取乙酸正丁酯的酯化率與HPW負載量的關系(溫度:120℃,時間:2h)如圖所示,下列說法不正確的是
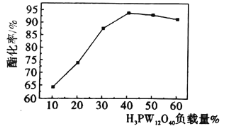
A.與HPW相比,HPW/硅藻土比表面積顯著增加,有助于提高其催化性能
B.當HPW負載量為40%時達到飽和,酯化率最高
C.用HPW/硅藻土代替傳統催化劑,可減少設備腐蝕等不足
D.不同催化劑對酯化率的影響程度主要取決于化學反應正向進行的程度
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】一定溫度下,硫酸鹽 MSO4(M2+代表 Ba2+、Sr2+)的沉淀溶解平衡曲線如圖所示。已知:p ( M2+ ) =-lgc ( M2+ ),p(SO42-)=-lgc(SO42-)。向 10mL 0.01 mol/L Na2SO4 溶液中滴入 1 滴(約 0. 05 mL) 0. 01 mol/L BaCl2 溶液岀現白色渾濁,而滴入 1 滴(約 0. 05 mL) 0. 01 mol/L SrCl2 溶液無渾濁出現。下列說法中錯誤的是
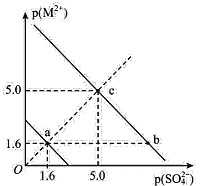
A.該溫度下,溶度積常數 Ksp(BaSO4)<Ksp( SrSO4)
B.欲使c點對應BaSO4溶液移向b點,可加濃BaCl2溶液
C.欲使c點對應SrSO4溶液移向a點,可加濃SrCl2溶液
D.SrSO4(s)+Ba2+(aq)BaSO4(s)+Sr2+(aq)的平衡常數為106.8
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】某密閉容器中發生反應:N2(g)+3H2(g)![]() 2NH3(g)ΔH<0,達到化學平衡狀態,下列說法正確的是( )
2NH3(g)ΔH<0,達到化學平衡狀態,下列說法正確的是( )
A.其他條件不變時,增大c(N2),H2的平衡轉化率增大
B.其他條件不變時,降低溫度,n(NH3)減小
C.其他條件不變時,增大壓強,該反應的平衡常數增大
D.其他條件不變時,升高溫度,該反應的化學反應速率加快
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】我國規定,所有銷售的食品包裝標簽配料表上食品添加劑應使用規定的產品名稱或種類名稱,其中甜味劑、防腐劑、著色劑應注明。右圖標簽注明的添加劑中屬于著色劑的是
①檸檬酸 ②山梨酸鉀 ③甜味素
④菠蘿香精 ⑤檸檬黃 ⑥日落黃

A.①②⑤B.②⑤⑥C.⑤⑥D.③④
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】某固體混合物可能由Al、(NH4)2SO4、MgCl2、FeCl2、AlCl3中的兩種或多種組成,現對該混合物做如下實驗,所得現象和有關數據如圖所示(氣體體積數據已換算成標準狀況下的體積)。關于該固體混合物,下列說法正確的是

A. 一定含有Al,其質量為4.05g
B. 一定不含FeCl2,可能含有MgCl2和AlCl3
C. 一定含有MgCl2 和FeCl2
D. 一定含有(NH4)2SO4 和MgCl2,且物質的量相等
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】鋁是地殼中含量最高的金屬元素,其單質及其化合物在生產生活中的應用十分廣泛。
(1)鋁原子最外層電子排布式是________,鋁原子核外有___種能量不同的電子。
(2)1827年,德國化學家維勒用金屬鉀與無水氯化鋁反應而制得了金屬鋁。不用鉀與氯化鋁溶液制鋁的理由是_________;現代工業煉鋁是以Al2O3為原料,與冰晶石(Na3A1F6)在熔融狀態下進行電解,其陰極電極反應式為___________________________。
(3)用鋁和金屬氧化物反應制備金屬單質是工業上較常用的方法。如:2Al+4BaO![]() 3Ba↑+BaO·Al2O3,用化學平衡移動原理解釋上述方法可制取金屬Ba的原因是________。
3Ba↑+BaO·Al2O3,用化學平衡移動原理解釋上述方法可制取金屬Ba的原因是________。
(4)LiAlH4由Li+、A1H4-構成,是有機合成中常用的試劑,LiAlH4在125℃分解為LiH、H2和Al。
①比較Li+、 H-、Al3+、H+離子半徑大小____________。
②寫出LiAlH4分解的方程式(需配平)_______,若反應生成3.36 L氫氣(標準狀況下),則有____g鋁生成。
③LiAlH4與乙醛反應可生成乙醇,推斷LiAlH4是反應的_________劑。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】醋酸亞鉻是一種氧氣吸收劑, 通常以二水鹽[Cr(CH3COO)2]2 ·2H2O(式量:376)的形式存在,難溶于冷水,易溶于鹽酸。其制備原理和實驗裝置:
制備原理:![]()
實驗裝置:(如圖所示)
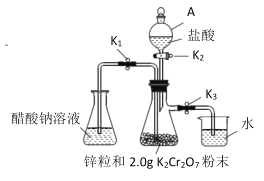
(1)儀器 A 的名稱是__________。
(2)裝好試劑后按上述裝置進行實驗,完成下表內容。
操作步驟 | 實驗現象 | 發生反應的離子方程式 |
關閉①___________________,打開②_______________,(用K1、K2、K3填寫,下同)使鹽酸緩慢加入至抽濾瓶中 | 抽濾瓶中鋅粒溶解,溶液由橙色逐漸變成藍色,有少量氣泡 | ③________,Zn+2H+=Zn2++H2↑ |
抽濾瓶中產生大量氣體時快速加入適量鹽酸,關閉K2和④__________________,打開⑤_________ | 抽濾瓶中⑥____________ | Zn+2H+=Zn2++H2↑ |
當溶液完全轉移后,迅速塞緊錐形瓶,用冷水冷卻 | 錐形瓶中有深紅色晶體析出 | ⑦_____________ |
(3)洗滌產品后干燥、稱量,得到 1.0g 固體。列式表示產率:____(不必計算出結果,K2Cr2O7 式量:294)。在實驗中如果鹽酸過量,會導致產率偏________。(填“高”或“低”)
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com