
【題目】按下圖裝置進行實驗,并回答下列問題:

(1)判斷裝置的名稱:A池為___________ ;B池為______________;
(2)鋅極為________極,電極反應式為___________________________________;銅極為________極,電極反應式為___________________________________;石墨棒C1為______極,電極反應式為__________________________________;石墨棒C2附近發生的實驗現象為______________________________________;
(3)當C2極析出224mL氣體(標準狀態)時,鋅的質量變化_________(變大、不變或變小)了________g,CuSO4溶液的質量_________(增加、不變或減少)_________g。
【答案】原電池 電解池 負極 Zn—2e-=Zn2+ 正極 Cu2++2e-=Cu 陽極 2Cl--2e-=Cl2↑ 溶液呈紅色 變小 0.65 增加 0.01
【解析】
(1)由題給裝置可知,A為原電池,B為電解池;
(2)A為原電池,金屬活潑性較強的鋅為負極,電極反應式為Zn-2e-=Zn2+;金屬活潑性較弱的銅為正極,電極反應為:Cu2++2e-=Cu,石墨棒C1與原電池的正極相連為電解池的陽極,陽極上氯離子失電子生成氯氣,電極反應式為:2Cl--2e-=Cl2↑;石墨棒C2與原電池的負極相連為電解池的陰極,電極反應式為2H++2e-=H2↑,陰極附近生成氫氣和氫氧根離子,溶液呈變紅;
(3)石墨棒C2與原電池的負極相連為電解池的陰極,電極反應式為2H++2e-=H2↑,當C2極析出224mL氣體(標準狀況)時,生成氫氣的物質的量為0.01mol,轉移的電子為0.02mol,鋅電極的方程式為:Zn-2e-=Zn2+,根據電子守恒可知,消耗的Zn為0.01mol,則鋅的質量減少0.65g,生成銅的物質的量為0.01mol,質量為6.4g,硫酸銅溶液質量增加0.01g。


科目:高中化學 來源: 題型:
【題目】某同學設計如下實驗方案,以分離KCl和BaCl2兩種固體混合物,試回答下列問題:

供選試劑:Na2SO4溶液、K2CO3溶液、K2SO4溶液、鹽酸
(1)操作①的名稱是________,操作②的名稱是____________。
(2)試劑a是____________(填化學式,下同),試劑b是__________,固體B是____________。
(3)加入試劑a所發生反應的化學方程式為__________________________________。
加入試劑b所發生反應的化學方程式為____________________________________。
(4)該方案能否達到實驗目的:__________________________(填“能”或“不能”)。若不能,應如何改進?(若能,此問不用回答)__________。
(5)若要測定原混合物中BaCl2的質量分數,除了要準確稱量混合物的質量外,至少還要獲得的數據是____的質量。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】如下圖所示的裝置,C、D、E、F、X、Y都是惰性電極。將電源接通后,向乙中滴入酚酞溶液,在F極附近顯紅色。試完成以下問題:

(1)電源A極的名稱是________。
(2)甲裝置中電解反應的總化學方程式是____________。
(3)如果收集乙裝置中產生的氣體,兩種氣體的體積比是________。
(4)欲用丙裝置給銅鍍銀,G應該是________(填“銅”或“銀”),電鍍液的主要成分是________(填化學式) 。
(5)裝置丁的現象是________,說明________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】活性ZnO在橡膠、塑料、涂料工業有重要應用,工業上用含鋅物料(含FeO、CuO等雜質)制取活性ZnO的流程如圖所示:

(1)上述流程中,浸出時用的是60% H2SO4(密度是1.5 g/cm3),則該H2SO4的物質的量濃度為______________ (保留兩位小數) 。
(2)上述流程H2SO4浸出后溶液中Fe3+的濃度為0.04 mol·L-1,控制濾液的pH,加入H2O2后產生大量紅褐色沉淀。
①粗略測定溶液pH的實驗操作是___________________________________________。
②已知:常溫下Fe(OH)3的Ksp=4.0×10-38。濾液的pH至少為________時,溶液中Fe3+開始沉淀。
(3)A溶液中主要含有的溶質是______________,驗證溶質所含陽離子的方法是_____________。
(4)制備ZnO所焙燒的物質是含結晶水的堿式碳酸鋅。取堿式碳酸鋅6.82g,溶于HCl生成CO2 448 mL(標準狀況下),溶解過程消耗HCl 0.12mol,若該堿式鹽中氫元素的質量分數為1.76%,試推測該堿式碳酸鋅的化學式_________________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】為了除去粗鹽中的![]() 及泥沙,可將粗鹽溶于水,然后進行下列五項操作。正確的操作順序是( )
及泥沙,可將粗鹽溶于水,然后進行下列五項操作。正確的操作順序是( )
①過濾 ②加過量![]() 溶液 ③加過量鹽酸
溶液 ③加過量鹽酸
④加熱煮沸 ⑤加過量的![]() 溶液 ⑥過量
溶液 ⑥過量![]() 溶液。
溶液。
A.②⑤⑥①③④B.⑤②⑥③①④C.⑥②⑤③④①D.⑥②①⑤③④
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】某研究性學習小組欲測定室溫下(25℃,101kPa)的氣體摩爾體積,請回答以下問題。該小組設計的簡易實驗裝置如圖所示:

該實驗的主要操作步驟如下:
①配制 100 mL 1.0mol/L的鹽酸溶液:.
②用_______________(填儀器名稱并注明規格)量取7.5mL 1.0mol/L的鹽酸溶液加入錐形瓶中;
③稱取ag已除去表面氧化膜的鎂條,并系于銅絲未端,為使HCl全部參加反應,a的數值至少為__________;
④往廣口瓶中裝入足量水,按上圖連接好裝置,檢查裝置的氣密性;
⑤反應結束后待體系溫度恢復到室溫,忽略導管中的水,讀出量筒中水的體積為91.9mL
請將上述步驟補充完整并回答下列問題。
(1)步驟①中所需要帶刻度的儀器為__________,若用36.5%的濃鹽酸(密度為1.20g/mL)
進行稀釋配制,則需要量取該濃鹽酸___________mL
(2)步驟①中,配制100 mL 1.0mol/L的鹽酸溶液時,下列哪些操作會使配制濃度偏低___________(填寫字母).
A.用量筒量取濃鹽酸時,俯視量筒的刻度
B.容量瓶未干燥即用來配制溶液.
C.未洗滌燒杯和玻璃棒
D.定容完成后,將容量瓶倒置搖勻后;發現液面低于刻度線
E.在容量瓶中定容時俯視容量瓶刻度線.
F.燒杯中有少量水.
(3)請填寫操作步驟中的空格:步驟②_________步驟③_______________
(4)實驗步驟5中應選用______________(填字母)的量筒。.'
A.100 mL B.200mL C.500mL
(5)忽略水蒸氣影響,在該條件下測得氣體摩爾體積為Vm=_____________L/mol(保留2位小數)
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】某化學教師為“氯氣與金屬鈉反應”設計了如圖裝置的實驗。實驗操作:先給鈉預熱,等鈉熔融成圓球時,撤火,通入氯氣,即可見鈉著火燃燒,生成大量白煙。以下敘述中錯誤的是
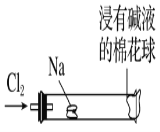
A.反應生成的大量白煙是氯化鈉晶體
B.玻璃管尾部塞一團浸有NaOH溶液的棉球是用于吸收過量的氯氣
C.鈉著火產生黃色火焰,自然界中存在游離態鈉
D.若在棉花球外沿滴一滴石蕊溶液,據其顏色變化判斷氯氣是否被堿液完全吸收
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】按要求回答下列問題:
(1)甲醇是一種重要的化工原料,有著重要的用途和應用前景。工業上一般采用下列兩種反應合成甲醇:
反應I:CO(g)+2H2(g)CH3OH(g);△H1
反應II:CO2(g)+3H2(g)CH3OH(g)+H2O(g);△H2
①上述反應中原子利用率百分之百的是______(填“I”或“Ⅱ”)
②下表所列數據是反應I在不同溫度下的化學平衡常數(K)
溫度 | 250℃ | 300℃ | 350℃ |
K | 2.041 | 0.270 | 0.012 |
由表中數據判斷△H1______0,T℃時,將2molCO和6molH2充入2L的密閉容器中,充分反應,達到平衡后,測得c(CO)=0.2mol/L,此時T為______。
(2)已知在常溫常壓下:
①2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(g)△H1=-1275.6kJ/mol
②2CO(g)+O2(g)=2CO2(g)△H2=-566.0kJ/mol
③H2O(g)=H2O(l)△H3=-44.0kJ/mol
寫出甲醇不完全燃燒生成一氧化碳和液態水的熱化學方程式:______。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】某合金只含鋁、鐵、銅三種元素,取合金![]() ,加入到含
,加入到含![]() 稀硝酸的溶液中,恰好完全反應,放出無色氣體11.2L(標準狀況下)。將反應后的溶液分成2等份,向一份溶液中滴加
稀硝酸的溶液中,恰好完全反應,放出無色氣體11.2L(標準狀況下)。將反應后的溶液分成2等份,向一份溶液中滴加![]() ,無明顯現象。向另一份溶液中滴加氨水至過量,過濾得沉淀bg,充分灼燒得固體cg,減輕了5.4g,再加入到過量的
,無明顯現象。向另一份溶液中滴加氨水至過量,過濾得沉淀bg,充分灼燒得固體cg,減輕了5.4g,再加入到過量的![]() 溶液中,剩余不溶物dg。下列說法不正確的是
溶液中,剩余不溶物dg。下列說法不正確的是
已知;![]() 遇到
遇到![]() 會出現藍色沉淀。
會出現藍色沉淀。
A. ![]()
B. 原合金中銅的質量為![]()
C. 若將上述![]() 稀硝酸逐滴加入到合金中,放出氣體仍為
稀硝酸逐滴加入到合金中,放出氣體仍為![]() (標準狀況下)
(標準狀況下)
D. d不是一確定值,可能為8
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com