
【題目】在10L密閉容器中,1molA和3molB在一定條件下反應:A(g)+xB(g)![]() 2C(g),2min后反應達到平衡時,測得混合氣體共3.4mol,生成0.4molC,則下列計算結果不正確的是( )
2C(g),2min后反應達到平衡時,測得混合氣體共3.4mol,生成0.4molC,則下列計算結果不正確的是( )
A.平衡時,物質的量比A:B:C=2:11:4
B.x值等于4
C.A的轉化率20%
D.B的平均反應速率為0.04mol·L-1·min-1
 名校課堂系列答案
名校課堂系列答案科目:高中化學 來源: 題型:
【題目】物質G是制備抗癌藥物吉非替尼過程中重要的中間體,某研究小組按照下列線路合成中間體G。

已知: 、
、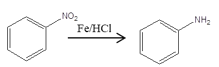 、
、 (同時還有H2O或鹵化氫生成)
(同時還有H2O或鹵化氫生成)
請回答:
(1)下列說法正確的是_______。
A.化合物A能夠使酸性高錳酸鉀溶液褪色
B.化合物A中含有4種不同的官能團
C.化合物C具有堿性
D.化合物G的分子式為C15H20N3O3
(2)上述路線中合成A的反應類型為______,化合物E的結構簡式為______。
(3)寫出C到D的化學反應方程式________。
(4)請設計以乙烯為原料轉變為物質C的合成線路(用流程圖表示,無機試劑任選)___。
(5)寫出化合物B(C8H7NO2)可能的同分異構體_______。須同時滿足:①能發生銀鏡反應;②1H—NMR譜顯示分子中含有苯環,且分子中有4種不同化學環境的氫原子。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】反應NH4Cl+NaNO2![]() NaCl+N2↑+2H2O放熱且產生氣體,可用于冬天石油開采。下列表示反應中相關微粒的化學用語正確的是
NaCl+N2↑+2H2O放熱且產生氣體,可用于冬天石油開采。下列表示反應中相關微粒的化學用語正確的是
A. 中子數為18的氯原子:![]()
B. N2的結構式:N=N
C. Na+的結構示意圖: 
D. H2O的電子式: ![]()
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】設NA為阿伏加德羅常數的值,下列說法正確的是
A. 100g46%甲酸(HCOOH)水溶液所含的氧原子數為5NA
B. 標準狀況下,18g冰水中共價鍵的數目為NA
C. 56g鐵與71gCl2充分反應,轉移電子數目為3NA
D. 7.8gNa2O2與足量的水(H218O)反應生成的氧氣所含的中子數為0.5NA
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】高溫下,超氧化鉀晶體(KO2)呈立方體結構。如圖為超氧化鉀晶體的一個晶胞(晶體中最小的重復單元)。則下列有關說法正確的是( )

A. KO2中只存在離子鍵
B. 超氧化鉀的化學式為KO2,每個晶胞含有1個K+和1個O2-
C. 晶體中與每個K+距離最近的O2-有6個
D. 晶體中,所有原子之間都以離子鍵相結合
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】工業上利用廢鎳催化劑(主要成分為Ni,還含有一定量的Zn、Fe、SiO2、CaO)制備草酸鎳晶體(NiC2O4·2H2O)的流程如下:
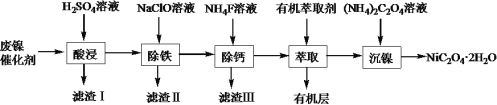
(1)NiC2O4·2H2O中C的化合價是______。既能加快“酸浸”反應速率又能提高“酸浸”原料利用率的操作措施為_____________。
(2)“濾渣Ⅰ”的主要成分是_____________。若控制溫度為80℃、pH=2時,“除鐵”產生的“濾渣Ⅱ”的主要成分為黃鈉鐵礬(Na2Fe6(SO4)4(OH)12),寫出生成黃鈉鐵礬沉淀的離子方程式:__________________。
(3)已知“濾渣Ⅲ”的主要成分為CaF2,則“萃取”操作中加入有機萃取劑的作用是__________。
(4)在隔絕空氣的條件下,高溫煅燒無水NiC2O4得到Ni2O3和兩種含碳元素的氣體,該反應的化學方程式是_________。
(5)高能鋰離子電池的總反應為2Li + FeS = Fe + Li2S。用該電池作電源電解含鎳酸性廢水回收Ni的裝置如圖(圖中X、Y為電極,LiPF6·SO(CH3)2為電解質)。
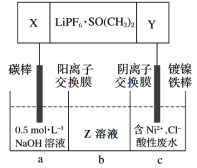
①電極X的反應材料是_________(填化學式);中間隔室b可以得到的主要物質Z是_________(填化學式)。
②電解總反應的離子方程式為_________。已知F=96500C/mol,若電池工作t min,維持電流強度為I A,理論回收Ni_________g(寫出計算表達式即可)。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】利用圖示裝置進行實驗,反應進行足夠長時間后裝置II中實驗現象正確的是
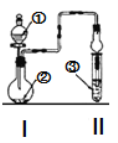
① | ② | ③ | II中實驗現象 | |
A | 濃鹽酸 | 大理石 | 氯化鋇溶液 | 產生大量白色沉淀 |
B | 濃氨水 | 堿石灰 | 硫酸亞鐵溶液 | 產生大量白色沉淀 |
C | 冰醋酸 | 乙醇和濃硫酸 | 飽和碳酸鈉溶液 | 溶液分層,上層為油狀液體 |
D | 濃鹽酸 | KMnO4 | 氫硫酸 | 產生淡黃色沉淀 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】維生素C(又名抗壞血酸,分子式為C6H8O6)具有較強的還原性,放置在空氣中易被氧化,其含量可用已知濃度的標準I2溶液進行滴定(弱酸性性環境)。該反應的化學方程式為:C6H8O6+I2 = C6H6O6+2HI具體測定步驟及測得數據如下:取10 mL 6 mol·L-1CH3COOH溶液,加入100 mL蒸餾水,將溶液加熱煮沸后冷卻。精確稱取0.2000 g樣品,溶解于上述冷卻的溶液中,加入1mL指示劑,立即用濃度為0.0500 mol·L-1的標準I2溶液進行滴定到終點,消耗21.00 mL I2溶液。
(1)實驗中的指示劑是____________確定達到滴定終點的現象是_____________。
(2)盛裝標準I2溶液的是_________(酸式或堿式)滴定管,若滴定結束時俯視滴定管讀數(其它操作正確)則滴定結果_______(偏高、偏低或無影響)。
(3)加入的CH3COOH稀溶液要先經煮沸、冷卻后才能使用,其目的是_____________。
(4)計算樣品中維生素C的質量分數____________(要求列式,且式中各物理量帶單位)。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】鐵氮化合物(FexNy)在磁記錄材料領域有著廣泛的應用前景。某FexNy的制備需鐵、氮氣、丙酮和乙醇參與。
(1)Fe3+基態核外電子排布式為___未成對電子數為___個。
(2)丙酮(![]() )分子中碳原子軌道的雜化類型是___,丙酮分子中含有σ鍵的數目為____個。
)分子中碳原子軌道的雜化類型是___,丙酮分子中含有σ鍵的數目為____個。
(3)C、H、O三種元素的電負性由小到大的順序為___。
(4)乙醇的沸點高于丙酮,這是因為___。
(5)利用價層電子對互斥理論判斷PCl3的立體構型是___。
(6)某FexNy的晶胞如圖-1所示,Cu可以完全替代該晶體中a位置Fe或者b位置Fe,形成Cu替代型產物Fe(x-n) CunNy。FexNy轉化為兩種Cu替代型產物的能量變化如圖-2 所示,其中更活潑的Cu替代型產物的化學式為___。

查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com