
【題目】[化學--選修5:有機化學基礎]氰基丙烯酸酯在堿性條件下能快速聚合為![]() ,從而具有膠黏性,某種氰基丙烯酸酯(G)的合成路線如下:
,從而具有膠黏性,某種氰基丙烯酸酯(G)的合成路線如下:
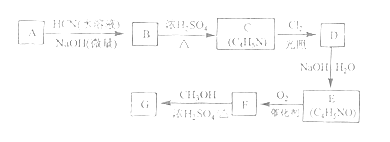
已知:①A的相對分子量為58,氧元素質量分數為0.276,核磁共振氫譜顯示為單峰
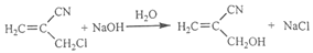
②
回答下列問題:
(1)A的化學名稱為_______。
(2)B的結構簡式為______,其核磁共振氫譜顯示為______組峰,峰面積比為______。
(3)由C生成D的反應類型為________。
(4)由D生成E的化學方程式為___________。
(5)G中的官能團有_____、 _____ 、_____。(填官能團名稱)
(6)G的同分異構體中,與G具有相同官能團且能發生銀鏡反應的共有_____種。(不含立體異構)
【答案】(1)丙酮
(2)![]() 2 6:1
2 6:1
(3)取代反應
(4)
(5)碳碳雙鍵酯基氰基
(6)8
【解析】
試題分析:(1)A的相對分子量為58,氧元素質量分數為0.276,則氧原子個數為58×0.276÷16=1,再根據商余法,42÷12=3…6,A分子的分子式為C3H6O,核磁共振氫譜顯示為單峰,則A為丙酮。
(2)A為丙酮,根據已知②給的信息,B為![]() ,B分子中有2種氫原子,則其核磁共振氫譜顯示為2組峰,峰面積比為1:6。
,B分子中有2種氫原子,則其核磁共振氫譜顯示為2組峰,峰面積比為1:6。
(3)光照條件下與氯氣反應是取代反應的條件,則由C生成D的反應類型為取代反應。
(4)根據題給信息,由D生成E的化學方程式為![]() 。
。
(5)根據題給結構簡式,氰基丙烯酸酯為CH2=C(CN)COOR,根據流程圖提供的信息可知,G的結構簡式為CH2=C(CN)COOCH3,則G中的官能團有碳碳雙鍵、酯基、氰基。
(6)G的同分異構體中,與G具有相同官能團且能發生銀鏡反應的有機物為甲酸酯,將氰基看成氫原子,有三種結構:HCOOCH2CH=CH2、HCOOCH=CHCH3、HCOOC(CH3)=CH2,然后將氰基取代右面的碳原子上,共有8種。


 名校課堂系列答案
名校課堂系列答案科目:高中化學 來源: 題型:
【題目】針對網絡上流傳的隔夜熟肉中因亞硝酸鈉(NaNO2)含量嚴重超標而不能食用的說法,某興趣小組開展如下探究活動:
活動一:查閱資料
NaNO2有毒,具有氧化性和還原性,NaNO2溶液顯堿性,肉類在放置過程中,NaNO3逐漸轉化為NaNO2,國家規定肉制品中NaNO2含量不能超過30 mg/kg。
活動二:鑒別NaNO2與食鹽
(1)NaNO2與食鹽的外觀相似,易被當成食鹽誤用,分析以下兩種鑒別方法:
① 能否各取少許固體用舌頭品嘗?_____。(選填“能”或“不能”)
② 用稀硫酸、淀粉和KI溶液鑒別,溶液變藍的是NaNO2具有___性。
活動三:探究NaNO3與NaNO2的相互轉化
(2)制取NaNO2與NaNO3混合溶液的裝置如圖所示。
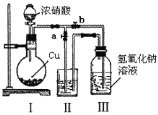
已知:2NO2+2NaOH=NaNO2+NaNO3+H2O。
① 寫出裝置I中發生反應的化學方程式___________________________________。
② 水_______(選填“能"或“不能”)作為裝置II中的試劑,理由是_________________。
③ 裝置III中反應完全后,接下來的操作是_________________________________。
(3)將NaNO2與NaNO3混合溶液露置于空氣,隔夜后,測得溶液的pH減小,則溶液中NaNO2的含量_______(選填“增多”、“減少"或“不變”),原因可能是______________(用化學方程式解釋)。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】某學生為了探究鋅與鹽酸反應過程中的速率變化,他在100mL稀鹽酸中加入足量的鋅粉,用排水集氣法收集反應放出的氫氣,實驗記錄如下(累計值):

(1) 哪一時間段(指①0~1、②1~2、③2~3、④3~4、⑤4~5 min,下同)反應速率最大 ,(填序號,下同) ,原因是 。
(2) 哪一段時段的反應速率最小 ,原因是 。
(3) 求2~3分鐘時間段以鹽酸的濃度變化來表示的該反應速率(設溶液體積不變,不要求寫出計算過程) 。
(4) 如果反應太激烈,為了減緩反應速率而又不減少產生氫氣的量,他在鹽酸中分別加入等體積的下列溶液:[A.蒸餾水 B.NaCl溶液 C Na2CO3溶液 D.CuSO4溶液
你認為可行的是(填編號) 。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】測定稀硫酸和稀氫氧化鈉中和熱的實驗裝置如圖所示。某興趣小組的實驗數值結果大于57.3 kJ·mol-1(中和熱),原因可能是

A. 實驗裝置中小燒杯杯中低于大燒杯杯口
B. 用濃硫酸代替了稀硫酸
C. 分多次把NaOH溶液倒入盛有硫酸的小燒杯中
D. 用溫度計測定NaOH溶液起始溫度后未洗滌,直接測定H2SO4溶液的溫度
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下表是元素周期表的一部分,所列的字母分別代表一種元素。
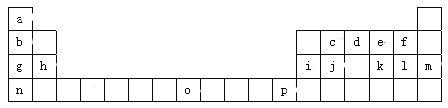
試回答下列問題:(填寫時用對應元素符號或物質的化學式)
(1)f、g、l的簡單離子的半徑由小到大的順序是 。
(2)原子Zn位于周期表中的 區,元素o在周期表中的位置是 ,元素o的二價陽離子的核外電子排布式是 。
(3)根據下表所示原子逐級電離能的數據分析并回答
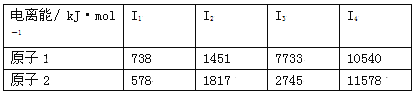
原子2對應周期表的元素是 ,原子1的第一電離能高于原子2的原因是 。
(4)周期表中所示各原子對應最高價氧化物的水化物堿性最強的是 (填水化物的化學式,下同),酸性最強的是 。寫出堿性最強的水化物與Al(OH)3反應的離子方程式 。
查看答案和解析>>
科目:高中化學 來源: 題型:
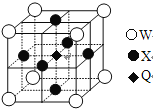
【題目】已知Q、R、X、Y、Z、W都是周期表中前四周期的元素,它們的核電荷數依次增大,其中Q原子外層電子數是內層電子數的兩倍;化合物R2Z的晶體為離子晶體,Z原子核外的M層中有兩對成對電子;X元素最外層電子數與最內層電子數相同;Y單質的晶體類型在同周期的單質中沒有相同的;W元素所在族有三列,只有兩個未成對的電子。請根據以上信息,回答下列問題:(答題時,Q、R、X、Y、Z、W用所對應的元素符號表示)
(1)W的外圍電子(價電子)排布式是 。
(2)Q、R、X、Y的第一電離能由小到大的順序為_ 。(用元素符號表示)
(3)QZ2分子的空間構型為 形。
(4)R的氯化物的熔點比Y的氯化物的熔點_ _(填高或低),理由是_ _ 。
(5)據報道,只含Q、X、W三種元素的晶體竟然具有超導性。鑒于這三種元素都是常見元素,從而引起廣泛關注。該晶體的結構如圖,試寫出該晶體的化學式_ 。晶體中每個X原子周圍距離最近的W原子有__ _個。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】煤燃燒排放的煙氣含有SO2和NOx,形成酸雨、污染大氣,采用NaClO2溶液作為吸收劑可同時對煙氣進行脫硫、脫硝。回答下列問題:
(1) NaClO2的化學名稱為_______。
(2)在鼓泡反應器中通入含有SO2和NO的煙氣,反應溫度為323 K,NaClO2溶液濃度為5×103mol·L1。反應一段時間后溶液中離子濃度的分析結果如下表。
離子 | SO42 | SO32 | NO3 | NO2 | Cl |
c/(mol·L1) | 8.35×104 | 6.87×106 | 1.5×104 | 1.2×105 | 3.4×103 |
①寫出NaClO2溶液脫硝過程中主要反應的離子方程式__________。增加壓強,NO的轉化率______(填“提高”、“不變”或“降低”)。
②隨著吸收反應的進行,吸收劑溶液的pH逐漸______ (填“增大”“不變”或“減小”)。
③由實驗結果可知,脫硫反應速率______脫硝反應速率(填“大于”或“小于”)。原因是除了SO2和NO在煙氣中的初始濃度不同,還可能是___________。
(3)在不同溫度下,NaClO2溶液脫硫、脫硝的反應中,SO2和NO的平衡分壓pe如圖所示。

①由圖分析可知,反應溫度升高,脫硫、脫硝反應的平衡常數均______________(填“增大”、“不變”或“減小”)。
②反應ClO2+2SO32===2SO42+Cl的平衡常數K表達式為___________。
(4)如果采用NaClO、Ca(ClO)2替代NaClO2,也能得到較好的煙氣脫硫效果。
①從化學平衡原理分析,Ca(ClO)2相比NaClO具有的優點是_______。
②已知下列反應:
SO2(g)+2OH (aq) ===SO32 (aq)+H2O(l) ΔH1
ClO (aq)+SO32 (aq) ===SO42 (aq)+Cl (aq) ΔH2
CaSO4(s) ===Ca2+(aq)+SO42(aq)ΔH3
則反應SO2(g)+ Ca2+(aq)+ ClO (aq) +2OH (aq) === CaSO4(s) +H2O(l) +Cl (aq)的ΔH=______。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】Ⅰ、有機物分子中的一個碳原子所連的4個原子或原子團均不相同時,該碳原子稱為手性碳原子,含有手性碳原子的化合物具有光學活性,某有機物X(結構如下)具有光學活性(式中標有*號的碳為手性碳原子),欲使其保持光學活性,發生以下 (選填序號)反應,該有機物仍一定具有光學活性。
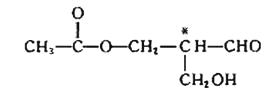
A.消去反應 | B.水解反應 | C.銀鏡反應 | D.酯化反應 |
Ⅱ、寫出由1-溴丁烷和必要的無機試劑制取1,2-二溴丁烷的化學方程式
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com