
【題目】“NaH2PO2還原法”制備高純度氫碘酸和亞磷酸鈉(Na2HPO3)的工業流程如圖。
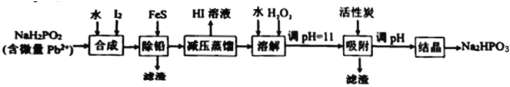
已知:25℃時,H3PO3的pKa1=1.3,pKa2=6.6。
(1)“合成”過程,主要氧化產物為H3PO3,相應的化學方程式為___________。
(2)“除鉛”過程,FeS除去微量Pb2+的離子方程式為___________。
(3)“減壓蒸餾”過程,I-回收率為95%,則剩余固體的主要成分為___________(填化學式)。
(4)“調pH=11”的作用是___________。
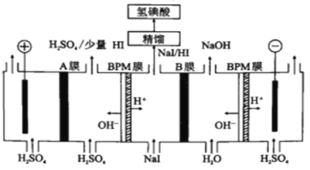
(5)氫碘酸也可以用“電解法”制備,裝置如圖所示。其中雙極膜(BPM)是陰、陽復合膜,在直流電的作用下,陰、陽膜復合層間的H2O解離成H+和OH-;A、B為離子交換膜。
①B膜最佳應選擇___________
②陽極的電極反應式是___________。
③少量的I-因為濃度差通過BPM膜,若撤去A膜,其缺點是:___________
【答案】NaH2PO2+I2+H2O=H3PO3+NaI+HI FeS(s)+Pb2+(aq)=PbS(s)+Fe2+(aq) NaH2PO3 除去鐵,并將NaH2PO3轉變為Na2HPO3 Na+離子交換膜 2H2O-4e-=O2↑+4H+ I-會在陽極放電,沉積在陽極表面,損傷陽極板
【解析】
“合成”步驟,NaH2PO2和I2和水反應生成H3PO3和NaI和HI;之后加入FeS將Pb2+轉化為PbS除去,此時溶液中的雜質為Fe2+;因為HI易揮發,“減壓蒸餾”獲得HI溶液,剩余固體主要為含有Fe2+雜質的NaH2PO3,加水溶解,再加入H2O2將Fe2+氧化成Fe3+,調pH=11將Fe3+轉化為沉淀除去,同時部分NaH2PO3轉換為了Na2HPO3;再次調pH將NaH2PO3徹底轉化為Na2HPO3,最后“結晶”得到Na2HPO3固體,據此分析解答。
(1)根據后續流程可知“合成”步驟中產生HI,說明I2將NaH2PO2氧化,HI為強酸,所以還生成H3PO3和NaI,根據電子守恒和元素守恒可得該反應的化學方程式為:NaH2PO2+I2+H2O= H3PO3+NaI+HI;
(2)“除鉛”過程,利用沉淀轉化原理,加入FeS將Pb2+變成PbS,離子方程式為:FeS(s)+Pb2+(aq)=Fe2+(aq)+PbS(s);
(3)根據合成步驟的反應,可知蒸餾前溶液中主要含H3PO3、NaI和HI,而蒸餾過程I-回收率為95%,說明H3PO3和NaI反應有NaH2PO3生成,則剩余固體的主要成分為NaH2PO3;
(4)“調pH=11”的作用:將Fe3+轉化為沉淀除去,同時將NaH2PO3轉換為了Na2HPO3;
(5)①從圖上看,右端的BPM膜和B膜之間產生NaOH,BPM膜提供OH-,所以B膜最好是鈉離子交換膜;
②陽極附近溶液為硫酸溶液,水電離的氫氧根失電子產生氧氣,同時產生氫離子,故陽極的電極反應式為:2H2O-4e-=O2↑+4H+;
③電解池中陰離子有向陽極移動的趨勢,少量的I-因為濃度差通過BPM膜,若沒有A膜的阻擋,I-會在陽極失電子得到碘單質,沉積在陽極表面,損傷陽極板。


 走進文言文系列答案
走進文言文系列答案科目:高中化學 來源: 題型:
【題目】下列說法中正確的是( )
A.25℃時某溶液中水電離出的c(H+)=1.0×1012 mol·L1,其pH一定是12
B.某溫度下,向氨水中通入CO2,隨著CO2的通入,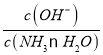 不斷增大
不斷增大
C.恒溫恒容下,反應X(g)+3Y(g) ![]() 2Z(g),起始充入3 mol X和3 mol Y,當X的體積分數不變時,反應達到平衡
2Z(g),起始充入3 mol X和3 mol Y,當X的體積分數不變時,反應達到平衡
D.某溫度下,向pH=6的蒸餾水中加入NaHSO4晶體,保持溫度不變,測得溶液的pH為2,該溫度下加入等體積pH=10的NaOH溶液可使反應后的溶液恰好呈中性
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】常溫下,下列各組離子一定能在指定溶液中大量共存的是
A. pH=l 的溶液中:Ba2+、Fe3+ 、Cl-、SCN-
B. 能使酚酞變紅的溶液:Ca2+、K+、HCO3-、CO32-
C.  =10-12的溶液中:NH4+、Cu2+、NO3-、SO42-
=10-12的溶液中:NH4+、Cu2+、NO3-、SO42-
D. 由水電離的c(H+)=10-12mol·L-1的溶液中:Na+、Al3+、Cl-、NO3-
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】鐵是應用最廣泛的金屬,自遠古時代人類就學會了煉鐵,到目前為止,人類研制出了很多煉鐵的方法。某研究性學習小組同學在實驗室中模擬工業煉鐵的過程,實驗裝置如下:

(1)寫出得到單質鐵的化學方程式:_________________________。
(2)實驗過程中看到玻璃管內的粉末由紅棕色逐漸變黑,請設計一個實驗來驗證生成了單質鐵:______。
(3)裝置末端氣球的作用為_____________________________。實驗結束時,應該先停止加熱還是先停止通入CO?原因是什么?_______________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】某學生用0.2000mol·L-1的標準NaOH溶液滴定未知濃度的鹽酸,其操作步驟如下:
① 用蒸餾水洗滌堿式滴定管,并立即注入NaOH溶液至“0”刻度以上
② 固定好滴定管并使滴定管尖嘴充滿液體
④調節液面至“0”或“0”刻度線稍下,并記下讀數
④移取20.00mL待測液注入潔凈的錐形瓶中,并加入2滴酚酞溶液
⑤用標準液滴定至終點,記下滴定管液面讀數。
填空:(1)以上步驟有錯誤的是(填編號)_________,該錯誤操作會導致測定結果__________。(填“偏大”、“偏小”或“無影響”)
(2)步驟⑤中,在記錄滴定管液面讀數時,滴定管尖嘴有氣泡,導致測定結果____________。(填“偏大”、“偏小”或“無影響”)
(3)判斷滴定終點的現象是:___________________________________;
(4)如下圖是某次滴定時的滴定管中的液面,其讀數為_________mL

(5)根據下列數據:請計算待測鹽酸溶液的濃度:_______________________mol·L-1
滴定次數 | 待測液體積(mL) | 標準燒堿體積(mL) | |
滴定前讀數 | 滴定后讀數 | ||
第一次 | 20.00 | 0.40 | 20.40 |
第二次 | 20.00 | 4.00 | 24.00 |
第三次 | 20.00 | 2.00 | 24.10 |
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】如圖,將一根純鐵棒垂直沒入水中,一段時間后發現AB段產生較多鐵銹,BC段腐蝕嚴重.下列關于此現象的說法不正確的是
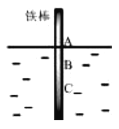
A.鐵棒AB段的溶解氧濃度高于BC段
B.鐵棒AB段電極反應為O2+2H2O+4e-=4OH-
C.鐵棒AB段的Fe2+濃度高于BC段
D.該腐蝕過程屬于電化學腐蝕
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列離子方程式正確的是( )
A.澄清石灰水與過量碳酸氫鈉溶液反應:HCO3-+Ca2++OH-=CaCO3↓+H2O
B.硫酸氫鈉溶液中加入氫氧化鋇溶液至中性:2H++SO42-+Ba2++2OH﹣=BaSO4↓+2H2O
C.向氫氧化鈉溶液中通入足量CO2:2OH-+CO2=CO32-+H2O
D.向明礬[KAl(SO4)2·12H2O]溶液中逐滴加入Ba(OH)2溶液至SO42-恰好完全沉淀:2Al3++3SO42-+3Ba2++6OH-=2Al(OH)3↓+3BaSO4↓
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】有下列離子晶體的空間結構示意圖。圖中●和化學式中M分別代表陽離子,圖中○和化學式中N分別代表陰離子,則化學式為MN2的晶體結構為
A.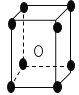 B.
B.
C.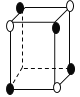 D.
D.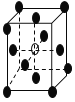
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】某恒溫恒容密閉容器中存在反應:X(g)+2Y(g)![]() Z(g) ΔH=-akJmol-1(a>0),現向該容器中充入等物質的量的X(g)與Y(g)充分反應。下列說法正確的是
Z(g) ΔH=-akJmol-1(a>0),現向該容器中充入等物質的量的X(g)與Y(g)充分反應。下列說法正確的是
A.體系中混合氣體的總壓強保持不變時,說明該反應達到化學平衡狀態
B.達到平衡時,反應放出的熱量一定小于akJ
C.達到平衡時,X與Y的物質的量之比仍為1∶1
D.達到平衡后,若升高體系溫度,則逆反應速率增大、正反應速率減小,平衡逆移
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com