
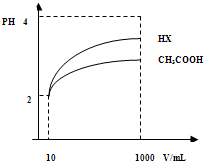
| 化學式 | CH3COOH | H2CO3 | HClO |
| 電離平衡常數 | 1.8×10-5 | K1=4.3×10-7 K2=5.6×10-11 |
3.0×10-8 |


科目:高中化學 來源: 題型:
 (2012?棗莊二模)物質在水溶液中的行為是中學化學的重要內容.已知下列物質的電離常數值(25℃):
(2012?棗莊二模)物質在水溶液中的行為是中學化學的重要內容.已知下列物質的電離常數值(25℃):
| ||
| ||
| 10-9 |
| x-10-2 |
| 10-9 |
| x-10-2 |
查看答案和解析>>
科目:高中化學 來源: 題型:
| a |
| 200b |
| a |
| 200b |

查看答案和解析>>
科目:高中化學 來源: 題型:
| a |
| 200 |
| a |
| 200 |
查看答案和解析>>
科目:高中化學 來源: 題型:
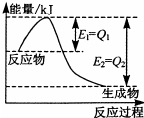 運用化學反應原理研究氮、硫、氯等單質及其化合物的反應有重要的意義.
運用化學反應原理研究氮、硫、氯等單質及其化合物的反應有重要的意義.查看答案和解析>>
科目:高中化學 來源:2013-2014學年江西省吉安市高三上學期期末教學質量評價化學試卷(解析版) 題型:填空題
開發使用清潔能源,發展“低碳經濟”正成為科學家研究的主要課題。氫氣、甲醇是優質的清潔燃料,可制作燃料電池。
(1)甲烷水蒸氣轉化法制H2的主要轉化反應如下:
CH4(g) + H2O(g) CO(g) + 3H2(g)? △H=+206.2 kJ·mol-1
CO(g) + 3H2(g)? △H=+206.2 kJ·mol-1
CH4(g) + 2H2O(g) CO2(g) + 4H2(g)? △H=+165.0 kJ·mol-1
CO2(g) + 4H2(g)? △H=+165.0 kJ·mol-1
上述反應所得原料氣中的CO能使合成氨的催化劑中毒,必須除去。工業上常采用催化劑存在下CO與水蒸氣反應生成易除去的CO2,同時可制得等體積的氫氣的方法。此反應稱為一氧化碳變換反應,該反應的熱化學方程式是??????? 。
(2)生產甲醇的原料CO和H2來源于:CH4(g) + H2O(g)  CO(g) + 3H2(g)? ΔH>0
CO(g) + 3H2(g)? ΔH>0
①一定條件下CH4的平衡轉化率與溫度、壓強的關系如圖a。則A、B、C三點處對應平衡常數(KA、KB、KC)的大小關系為___________。(填“<”、“>”、“=” );

②100℃時,將1 mol CH4和2 mol H2O通入容積為1 L的定容密封容器中,發生反應,能說明該反應已經達到平衡狀態的是__________
a.容器內氣體密度恒定??
b.單位時間內消耗0.1 mol CH4同時生成0.3 mol H2
c.容器的壓強恒定??????
d.3v正(CH4) = v逆(H2)
(3)25℃時,在20mL0.1mol/L氫氟酸中加入VmL0.1mol/LNaOH溶液,測得混合溶液的pH變化曲線如圖所示,下列說法正確的是_____。

A.pH=3的HF溶液和pH=11的NaF溶液中, 由水電離出的c(H+)相等
B.①點時pH=6,此時溶液中,c(F-)-c(Na+)=9.9×10-7mol/L
C.②點時,溶液中的c(F-)=c(Na+)
D.③點時V=20mL,此時溶液中c(Na+)=0.1mol/L
(4)長期以來,一直認為氟的含氧酸不存在。1971年美國科學家用氟氣通過細冰末時獲得HFO,其結構式為H—O—F。HFO與水反應得到HF和化合物A,該反應的化學方程式為????????????????????? 。
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com