
【題目】用壓強傳感器探究生鐵在pH=2和pH=4醋酸溶液中發生腐蝕的裝置及得到的圖像如下:
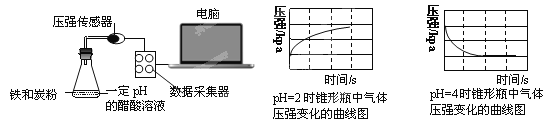
分析圖像,以下結論錯誤的是
A.溶液pH≤2時,生鐵發生析氫腐蝕
B.生鐵的腐蝕中化學腐蝕比電化學腐蝕更普遍
C.在酸性溶液中生鐵可能發生吸氧腐蝕
D.兩溶液中負極反應均為:Fe – 2e-===Fe2+
科目:高中化學 來源: 題型:
【題目】膠體區別于其他分散系的本質特征是( )。
A.膠體的分散質能通過濾紙,而濁液的分散質不能
B.產生丁達爾現象
C.分散質粒子直徑在1nm~100nm之間
D.膠體在一定條件下能穩定存在
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】100g濃度為18 mol/L密度為ρ g/mL 的濃硫酸中加入一定的水稀釋成9 mol/L的硫酸,則加入水的體積為 ( )
A. 小于100mL B. 等于100mL
C. 大于100mL D. 等于100/ρmL
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】按要求對下圖中兩極進行必要的連接并填空:
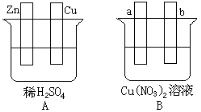
(1)在A圖中,使銅片上冒H2氣泡。請僅用導線進行必要的連接,此時銅板發生___________反應。電極反應式,鋅板: 。
(2)在B圖中,a、b均為石墨電極,若使a極析出銅,則請用導線等進行必要的連接,則b析出: 。電極反應式,a極: 。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】合成氨工業涉及固體燃料的氣化,需要研究CO2與CO之間的轉化。為了弄清其規律,讓一定量的CO2與足量碳在體積可變的密閉容器中反應:C(s)+CO2(g)![]() 2CO(g) H,測得壓強、溫度對CO、CO2的平衡組成的影響如圖所示:
2CO(g) H,測得壓強、溫度對CO、CO2的平衡組成的影響如圖所示:

回答下列問題:
(1)p1、p2、p3的大小關系是______________,欲提高C與CO2反應中CO2的平衡轉化率,應采取的措施為 。圖中a、b、c三點對應的平衡常數大小關系是____________。
(2)900 ℃、1.013 MPa時,1 mol CO2與足量碳反應達平衡后容器的體積為V,CO2的轉化率為_________,該反應的平衡常數K= 。
(3)將(2)中平衡體系溫度降至640 ℃,壓強降至0.1013 MPa,重新達到平衡后CO2的體積分數為50%。條件改變時,正反應和逆反應速率如何變化?____________,二者之間有何關系?___________。
(4)一定條件下,在CO2與足量碳反應所得平衡體系中加入H2和適當催化劑,有下列反應發生:
CO(g)+3H2(g)![]() CH4(g)+H2O(g) H1=-206.2 kJ/mol
CH4(g)+H2O(g) H1=-206.2 kJ/mol
CO(g)+H2O(g)![]() CO2(g)+H2(g) H2=-41.2 kJ/mol
CO2(g)+H2(g) H2=-41.2 kJ/mol
① 則二氧化碳與氫氣反應轉化為甲烷和水蒸氣的熱化學方程式是_________________。
② 已知298 K時相關化學鍵鍵能數據為:
化學鍵 | H—H | O—H | C—H |
|
E/(kJ·mol-1) | 436 | 465 | 413 | 1076 |
則根據鍵能計算,H1= ,它與上述實測值差異較大的原因可能是 。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】一種熔融碳酸鹽燃料電池原理示意如圖。下列有關該電池的說法正確的是

A.電極B上發生的電極反應為:O2+2CO2+4e-=2CO32-
B.電極A上H2參與的電極反應為:H2+2OH--2e-=2H2O
C.電池工作時,CO32-向電極B移動
D.反應CH4+H2O![]() 3H2+CO,每消耗1molCH4轉移12mol
3H2+CO,每消耗1molCH4轉移12mol
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】研究催化劑對化學反應有重要意義。為探究催化劑對雙氧水分解的催化效果,某研究小組做了如下實驗:
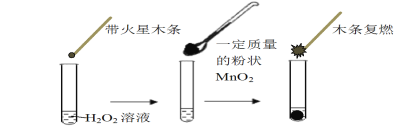
(1)甲同學欲用上圖所示實驗來證明MnO2是H2O2分解反應的催化劑,寫出該反應的化學方程式 。
(2)為探究MnO2的質量對催化效果的影響,乙同學分別量取50 mL 1% H2O2加入容器中,在一定質量范圍內,加入不同質量的MnO2,測量所得氣體體積,數據如下:
MnO2的質量/g | 0.1 | 0.2 | 0.4 |
40s末O2體積/mL | 49 | 61 | 86 |
由此得出的結論是 。
(3)為分析Fe3+和Cu2+對H2O2分解反應的催化效果,丙同學設計如下實驗(三支試管中均盛有10 mL 5% H2O2 ) :
試管 | Ⅰ | Ⅱ | Ⅲ |
滴加試劑 | 5滴0.1 mol·L-1 FeCl3 | 5滴0.1 mol·L-1 CuCl2 | 5滴0.3 mol·L-1 NaCl |
產生氣 泡情況 | 較快產生細小氣泡 | 緩慢產生細小氣泡 | 無氣泡產生 |
結論是 ,實驗Ⅲ的目的是 。
(4)查閱資料得知:將作為催化劑的FeCl3溶液加入H2O2溶液后,溶液中會發生兩個氧化還原反應,且兩個反應中H2O2均參加了反應,試從催化劑的角度分析,這兩個氧化還原反應的化學方程式分別是2FeCl3+H2O2=2FeCl2+O2↑+2HCl和 。
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com