
【題目】合成有機化合物J的流程如下所示。
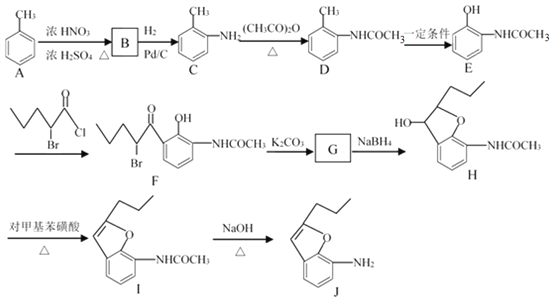
回答下列問題:
(1)B的名稱為______。
(2)C![]() D的反應類型為______,H
D的反應類型為______,H![]() I的反應類型為______。
I的反應類型為______。
(3)同時滿足下列條件D的同分異構體數目為______。
①能發生銀鏡反應;②分子結構中含有—NH2;③苯環上有兩個取代基,且苯環上的一氯代物有2種。若滿足①②條件,且苯環上的一氯代物只有1種,則其中一種物質的結構簡式為______。
(4)G的分子式為C13H15O3N,由F生成G的化學方程式為______。
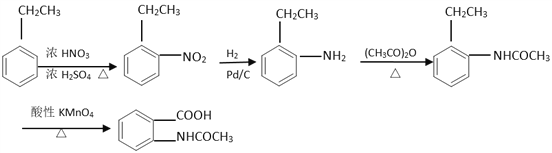
(5)已知:苯胺(![]() )易被氧化,請以乙苯和(CH3CO)2O為原料制備
)易被氧化,請以乙苯和(CH3CO)2O為原料制備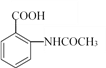 ,參照上述合成過程,寫出相應的合成路線流程圖(無機試劑任選)_________。
,參照上述合成過程,寫出相應的合成路線流程圖(無機試劑任選)_________。
【答案】 鄰硝基甲苯(2—硝基甲苯) 取代反應 消去反應 6 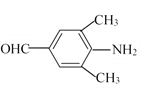
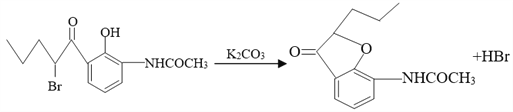
【解析】分析:甲苯發生硝化反應生成B,B發生還原反應生成C,根據C的結構簡式可知B是鄰甲基硝基苯。C與醋酸酐發生取代反應生成D,根據E與F的結構簡式可判斷E生成F是E分子中羥基鄰位的氫原子被取代生成F。根據H的結構簡式可知G的結構簡式為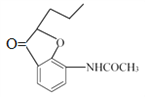 ,這說明生成G的反應是F分子中溴原子取代酚羥基上的氫原子形成五元環。I分子中含有碳碳雙鍵,說明H生成I的反應是羥基的消去反應。I分子中含有肽鍵,在氫氧化鈉溶液中水解生成J,據此解答。
,這說明生成G的反應是F分子中溴原子取代酚羥基上的氫原子形成五元環。I分子中含有碳碳雙鍵,說明H生成I的反應是羥基的消去反應。I分子中含有肽鍵,在氫氧化鈉溶液中水解生成J,據此解答。
詳解:(1)B的結構簡式為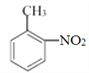 ,名稱為鄰硝基甲苯或2—硝基甲苯。
,名稱為鄰硝基甲苯或2—硝基甲苯。
(2)C→D是氨基上的氫原子被取代,反應類型為取代反應,H→I是羥基的消去反應,即反應類型為消去反應。
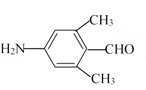
(3)D為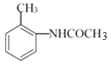 ,①能發生銀鏡反應,說明含有醛基;②分子結構中含有—NH2;③苯環上有兩個取代基,且苯環上的一氯代物有2種,因此兩個取代基處于對位位置。兩個取代基是-NH2和-CH2CH2CHO、-NH2和-CH(CH3)CHO、-CH2NH2和-CH2CHO、-CH2CH2NH2和-CHO、-CH(NH2)CH3和-CHO、-CH(NH2)CHO和-CH3,共計是6種;若滿足①②條件,且苯環上的一氯代物只有1種,則其中一種物質的結構簡式為
,①能發生銀鏡反應,說明含有醛基;②分子結構中含有—NH2;③苯環上有兩個取代基,且苯環上的一氯代物有2種,因此兩個取代基處于對位位置。兩個取代基是-NH2和-CH2CH2CHO、-NH2和-CH(CH3)CHO、-CH2NH2和-CH2CHO、-CH2CH2NH2和-CHO、-CH(NH2)CH3和-CHO、-CH(NH2)CHO和-CH3,共計是6種;若滿足①②條件,且苯環上的一氯代物只有1種,則其中一種物質的結構簡式為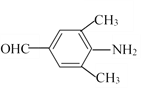 或
或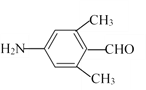 。
。
(4)G的分子式為C13H15O3N,由F生成G的化學方程式為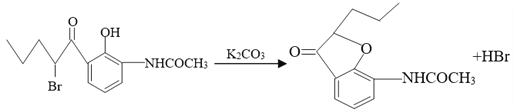 。
。
(5)根據已知信息結合逆推法可知以乙苯和(CH3CO)2O為原料制備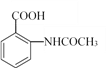 的合成路線流程圖為
的合成路線流程圖為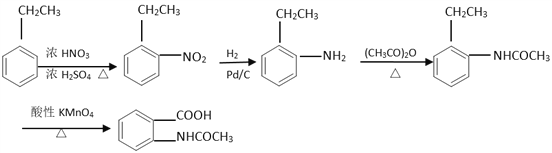 。
。


科目:高中化學 來源: 題型:
【題目】下列各組離子能大量共存,且當加入試劑后反應的離子方程式書寫正確的是( )
選項 | 離子組 | 加入試劑 | 發生反應的離子方程式 |
A | Fe3+、I-、Cl- | NaOH溶液 | Fe3+ + 3OH- =Fe(OH)3↓ |
B | K+、ClO-、SO42- | 鹽酸 | H++ClO- =HClO |
C | K+、OH-、Cl- | 過量SO2 | SO2+ OH-=HSO3- |
D | H+、Fe2+、 SO42- | Ba(NO3)2溶液 | SO42-+ Ba2+ =BaSO4↓ |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列說法正確的是( )
A. 常溫常壓下,22.4 L CO2中含有NA個CO2分子
B. 標況下22.4 L空氣含有NA個單質分子
C. 22.4 L Cl2中含有NA個Cl2分子
D. 標況下1.12L O2和1.12L CO2均含有0.1NA個氧原子
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】化學用語是學習化學的重要工具,下列用來表示物質變化的化學用語中,正確的是 ( )
A.鋼鐵發生電化學腐蝕的正極反應式:Fe -2e- == Fe2+
B.氫氧燃料電池的負極反應式:O2 + 2H2O + 4e- == 4OH-
C.粗銅精煉時,與電源正極相連的是純銅,電極反應式為:Cu -2e- == Cu2+
D.電解飽和食鹽水時,陽極的電極反應式為:2Cl- -2e-= Cl2 ↑
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】碳是自然界中形成化合物種類最多的元素,CO和CO2是碳的最常見氧化物。
(1)研究和解決二氧化碳捕集和轉化問題是當前科學研究的前沿領域。在太陽能的作用下,缺鐵氧化物[Fe0.9O]能分解CO2,其過程如圖1所示。過程①的化學方程式是______。在過程②中每產生0.1molO2,轉移電子______mol。

(2)在催化劑作用下,將二氧化碳和氫氣混合反應生成甲烷,是目前科學家們正在探索的處理空氣中的二氧化碳的方法之一。
①已知:
共價鍵 | C=O | H—H | C—H | O—H |
鍵能/(kJmol-1) | 745 | 436 | 413 | 463 |
則CO2(g)+4H2(g)![]() CH4(g)+2H2O(g) △H=______kJmol-1。
CH4(g)+2H2O(g) △H=______kJmol-1。
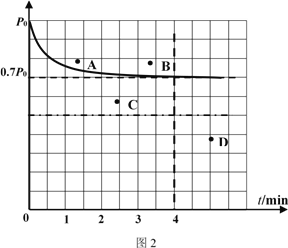
②向1L固定容積的密閉容器中加入4.0 mol H2(g)、1.0mol CO2,控制條件(催化劑:銠—鎂合金、高溫T1)使之反應,若測得容器內氣體的壓強隨著時間的變化如圖2所示。則4 min時容器內氣體的密度為______;溫度T1 下,該反應的化學平衡常為______。若采用2 L固定容積的密閉容器,投料量、催化劑和反應溫度均保持不變,則反應重新達到平衡時對應體系內的壓強的點是______(填字母)。
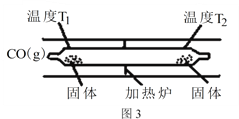
(3)工業合成原料氣CO會與設備、管道及催化劑表面的金屬鐵、鎳反應,生成羰基化合物。四羰基鎳是熱分解法制備高純鎳的原料,也是有機合成中供給一氧化碳的原料,還可做催化劑。Ni(s)+4CO(g)![]() Ni(CO)4(g) △H<0 Ni(CO)4(g)
Ni(CO)4(g) △H<0 Ni(CO)4(g)![]() Ni(s)+4CO(g)。如圖3所示,在石英真空管的溫度為T1一端,放入少量粗鎳和CO(g),一段時間后,在溫度為T2的一端可得到純凈的鎳。則溫度T1______T2(填“>”“<”或“=”),上述反應體系中循環使用的物質為______(填化學式)。
Ni(s)+4CO(g)。如圖3所示,在石英真空管的溫度為T1一端,放入少量粗鎳和CO(g),一段時間后,在溫度為T2的一端可得到純凈的鎳。則溫度T1______T2(填“>”“<”或“=”),上述反應體系中循環使用的物質為______(填化學式)。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】四種元素A、B、C、D,其中A元素原子的原子核內只有一個質子;B的基態原子s能級的總電子數比p能級的總電子數多1;C元素的原子最外層電子數是次外層的3倍;D是形成化合物種類最多的元素。
(1)A、D形成的某種化合物甲是一種重要的化工產品,可用作水果和蔬菜的催熟劑,甲分子中σ鍵和π鍵數目之比為________;寫出由甲制高聚物的反應方程式 。
(2)A、C形成的某種化合物乙分子中含非極性共價鍵,乙分子屬于________(“極性分子”或“非極性分子”);其電子式________;將乙加入淺綠色氯化亞銅溶液中,溶液變為棕黃色,寫出該反應的離子方程式______________。
(3)寫出B的基態原子電子排布圖為 。與PH3相比,BA3易液化的主要原因是_____________;
(4)笑氣(B2C)是一種麻醉劑,有關理論認為B2C與DC2分子具有相似的結構。故B2C的空間構型是________,其為________(填“極性”或“非極性”)分子。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】鋰離子電池已經成為應用最廣泛的可充電電池,某種鋰離子電池的結構示意圖如下,它在放電時有關離子轉化關系如圖所示,下列說法正確的是

A. Li+透過膜除允許Li+通過外,還允許H2O分子通過
B. 充電時,電池內部發生的總反應為Li++Fe2+![]() Li+Fe3+
Li+Fe3+
C. 充電時,鈦電極與外電源的負極相連
D. 放電時,進入貯罐的液體發生的離子反應方程式為:S2O82-+Fe2+=Fe3++2SO42-
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】為探究鐵和鐵的化合物的一些化學性質,某學生實驗小組設計了以下實驗。

(1)往A溶液中分別滴入幾滴KSCN溶液,溶液的顏色__________,
(2)根據上述過程寫出有關反應的離子方程式:Fe3O4→A _________________,A→B ___________。
(3)向B溶液中加入NaOH溶液,可看到的現象是_______________________________________,此過程中發生的氧化還原反應化學方程式為__________________________________。
(4)將A的飽和溶液滴入沸水中并不斷加熱,可制得_______________膠體;當光束通過該膠體時,可看到一條光亮的“通路”,這種現象稱為___________效應。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】工業從廢鉛酸蓄電池的渣泥(主要成分為PbSO4、PbO2)回收鉛。RSR 工藝的主要流程如下:
![]()
(1)鉛酸蓄電池放電時總反應為:
Pb(s) + PbO2(s) + 2H2SO4(aq) = 2PbSO4(s) + 2H2O(l)
正極反應:PbO2(s) + SO42-(aq) + 4H+(aq) + 2e- = PbSO4(s) + 2H2O(l)
負極反應:________。
(2)向渣泥中加入Na2CO3溶液將PbSO4轉化為更難溶的PbCO3。
①用化學平衡移動原理解釋其原因:________。
②工業上常用NaHCO3溶液代替Na2CO3溶液,將PbSO4轉化為PbCO3。PbSO4與NaHCO3溶液或Na2CO3溶液不同物質的量比時,PbSO4的轉化率見下表。
Ⅰ | n(PbSO4)∶ n(NaHCO3) | 1∶1.5 | 1∶2 | 1∶3 |
PbSO4轉化率/% | 95.5 | 96.9 | 97.8 | |
Ⅱ | n(PbSO4)∶ n(Na2CO3) | 1∶1.5 | 1∶2 | 1∶3 |
PbSO4轉化率/% | 98 | 98 | 98 |
依據上表數據,物質的量比相同時,Ⅱ中PbSO4的轉化率比Ⅰ中的略大,原因是________。
③上述反應除生成PbCO3外,還可能生成堿式碳酸鉛[2PbCO3·Pb(OH)2],二者受熱都易分解生成PbO。通過實驗確定產物中含有2PbCO3·Pb(OH)2,則該實驗操作及現象是________;通過定量實驗確定產物中2PbCO3·Pb(OH)2的含量,則需測定的數據是________。
(3)渣泥中加入Na2SO3溶液,利用其性質是________。
(4)H2SiF4溶液溶解PbCO3的化學方程式是________。
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com