
【題目】為減輕大氣污染,必須要加強對工業廢氣和汽車尾氣的治理,根據所學知識回答下列問題:
(1)化石燃料包括煤、石油和___。
(2)酸雨是指pH___(填“>”“<”或“=”)5.6的降水,煤的燃燒是導致酸雨形成的主要原因,而正常雨水的pH約為5.6,原因是___(用化學方程式表示)。
(3)在汽車尾氣排放口加裝“三效催化凈化器”,在不消耗其他物質的情況下,可將尾氣中的一氧化碳、一氧化氮轉化為參與大氣循環的氣體和無毒的氣體,該反應的化學方程式為___。
(4)在新能源汽車未普及時,如圖所示為一種“節能減排”的有效措施,以下對乙醇做汽車燃料的描述錯誤的是____(填字母,下同)。

A.原料來源豐富 B.是可再生能源 C.燃燒完全沒有污染
(5)Cu與稀HNO3反應的離子方程式為:___。
(6)工業上將氯氣通入石灰乳制取漂白粉,漂白粉的有效成分是___。
(7)用氫氧化鈉溶液可以吸收廢氣中的氮氧化物,反應的化學方程式如下:NO2+NO+2NaOH=2NaNO2+H2O、2NO2+2NaOH=NaNO2+NaNO3+H2O。現有VL某NaOH溶液能完全吸收nmolNO2和mmolNO組成的大氣污染物。
①所用燒堿溶液的物質的量濃度至少為____mol·L-1。
②若所得溶液中c(NO3-)∶c(NO2-)=1∶9,則原混合氣體中NO2和NO的物質的量之比n∶m=____。
【答案】天然氣 < CO2+H2O![]() H2CO3 2NO+2CO
H2CO3 2NO+2CO N2+2CO2 C 3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O Ca(ClO)2
N2+2CO2 C 3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O Ca(ClO)2 ![]() 3:2
3:2
【解析】
(1)煤、石油和天然氣是目前應用最多的化石燃料,故答案為:天然氣;
(2)酸雨是指pH小于5.6的雨水,正常的雨水因溶解了空氣中的二氧化碳氣體顯弱酸性,原因是二氧化碳與水反應產生了碳酸,反應為CO2+H2O![]() H2CO3,碳酸顯酸性,故答案為:<;CO2+H2O
H2CO3,碳酸顯酸性,故答案為:<;CO2+H2O![]() H2CO3;
H2CO3;
(3)尾氣中的一氧化碳、一氧化氮轉化為參與大氣循環的氣體和無毒的氣體,可知產物氣體為二氧化碳和氮氣,由此可得反應方程式為2NO+2CO N2+2CO2,故答案為:2NO+2CO
N2+2CO2,故答案為:2NO+2CO N2+2CO2;
N2+2CO2;
(4)A.工業乙醇可以淀粉或者纖維素水解后得到葡萄糖,葡萄糖發酵得到乙醇,而淀粉和纖維素可以從植物中獲得,來源豐富,故A正確;
B.由A分析可知乙醇可以來自于植物,植物是可再生的,因此乙醇是可再生能源,B正確;
C.乙醇燃燒時產生二氧化碳,同時也可會存在不完全燃燒產生一氧化碳,二氧化碳的大量排放會導致溫室效應,一氧化碳有毒,因此乙醇燃燒也會對環境有污染,故C錯誤;
答案選C。
(5)銅與稀硝酸反應產生硝酸銅,硝酸被還原成一氧化氮氣體,反應的離子方程式為:3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O,故答案為:3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O;
(6)氯氣通入石灰乳反應產生氯化鈣和次氯酸鈣,兩者為漂白粉的主要成分,其中次氯酸鈣具有強氧化性是漂白粉的有效成分,故答案為:Ca(ClO)2;
(7)①NO2+NO+2NaOH=2NaNO2+H2O、2NO2+2NaOH=NaNO2+NaNO3+H2O,由反應可知兩反應中氫氧化鈉與氣體的物質的量之比均為1:1,因此完全吸收nmolNO2和mmolNO時消耗氫氧化鈉的物質的量等于氣體的物質的量,即n(NaOH)=n(NO2)+n(NO)=(m+n)mol,所用燒堿溶液的物質的量濃度=![]() ,故答案為:
,故答案為:![]() ;
;
②若所得溶液中c(NO3-)∶c(NO2-)=1∶9,設硝酸根物質的量為1mol,則亞硝酸根物質的量為9mol,由反應2NO2+2NaOH=NaNO2+NaNO3+H2O可知,該反應產生的亞硝酸鈉等于硝酸鈉的物質的量,即也為1mol,該反應中消耗的二氧化氮為2mol;則NO2+NO+2NaOH=2NaNO2+H2O產生的亞硝酸鈉為9mol-1mol=8mol,該反應中消耗的二氧化氮和一氧化氮均為4mol,由此可得二氧化氮總量為2mol+4mol=6mol,一氧化氮為4mol,原混合氣體中NO2和NO的物質的量之比3:2,故答案為:3:2。


 閱讀快車系列答案
閱讀快車系列答案科目:高中化學 來源: 題型:
【題目】某溫度下,在2 L的密閉容器中,X、Y、Z三種氣體隨時間變化的曲線如圖所示。
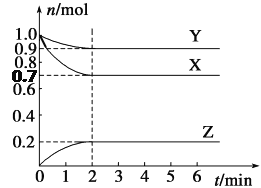
請回答下列問題:
(1)由圖中數據分析:該反應的化學方程式為__________________________。
(2)反應開始至2 min,Z的平均反應速率為________。
(3)5 min時Z的生成速率與6 min時Z的生成速率相比較,前者________后者(填“大于”、“小于”或“等于”)。
(4)上述反應過程中,如果降低溫度,則其反應速率________(填“增大”、“減小”或“不變)。如果使用合適的催化劑,則其反應速率________ (填“增大”、“減小”或“不變)。
(5)下列各項中不可以說明上述反應達到平衡的是________(填字母)。
a.混合氣體的密度不變
b.混合氣體的壓強不變
c.同一物質的正反應速率等于逆反應速率
d.X的濃度保持不變
e.生成1 mol Z和同時生成1.5 mol X
f.X、Y、Z的反應速率之比為3∶1∶2
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】如圖所示,800 ℃時A、B、C三種氣體在密閉容器中反應時濃度的變化,只從圖上分析不能得出的結論是
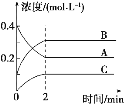
A. 發生的反應可表示為2A(g)![]() 2B(g)+C(g)
2B(g)+C(g)
B. 前2 min A的分解速率為0.1 mol/(L·min)
C. 開始時,正、逆反應同時開始
D. 2 min時,A、B、C的濃度之比為2∶3∶1
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】環之間共用一個碳原子的化合物稱為螺環化合物,螺[2,2]戊烷(![]() )是最簡單的一種。下列關于該化合物的說法不正確的是
)是最簡單的一種。下列關于該化合物的說法不正確的是
A. 與環戊烯互為同分異構體
B. 二氯代物超過四種(不考慮空間異構)
C. 所有碳原子均處同一平面
D. 由該物質生成1 mol C5H12需要2 mol H2
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】PET俗稱滌綸樹脂,是一種熱塑性聚酯;PMMA俗稱有機玻璃。工業上以基礎化工原料合成這兩種高分子材料的路線如下:
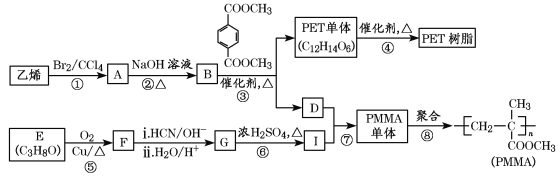
已知:Ⅰ.RCOOR′+R″OH![]() RCOOR″+R′OH(R、R′、R″代表烴基)
RCOOR″+R′OH(R、R′、R″代表烴基)
II、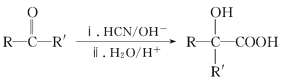 (R、R′、代表烴基)
(R、R′、代表烴基)
(1)指出下列反應的反應類型:反應③_________;反應⑥______。
(2)B的名稱為_______;
反應②的化學方程式為____________________________。
反應⑤的化學方程式為____________________________。
(3)PET單體(C12H14O6)的結構簡式為_______。
(4)下列說法正確的是________(填字母)。
a.B和D互為同系物
b.⑧為加聚反應
c.F和丙醛互為同分異構體
d.G能發生加成反應和酯化反應
(5)I的同分異構體中,滿足下列條件的有___________種。(不包括I)
①能與NaOH溶液反應;②含有碳碳雙鍵。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】常溫下,在20mL0.lmol/LNa2CO3溶液中逐滴加入40mL0.l mol/L 稀鹽酸,溶液中含碳元素各種微粒(CO2因逸出未畫出)的物質的量分數(縱軸)隨溶液pH變化的部分情況如圖所示。下列說法正確的是

A.曲線a表示H2CO3的變化曲線
B.H2CO3、HCO3-、CO32-可大量共存于同一溶液中
C.pH=11時,c(HCO3-)>c(Cl-)
D.碳酸鈉溶液的水解平衡常數為1.0×10-11
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】某有機物的結構簡式如圖,下列關于該有機物的說法正確的是
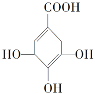
A.分子式為C7H6O5
B.分子中含有兩種官能團
C.該物質能發生加成反應,氧化反應和取代反應
D.在水溶液中羧基和羥基均能電離出H+
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】298K時,將20mL3xmol·L-1Na3AsO3、20mL3xmol·L-1I2和20mLNaOH溶液混合,發生反應:AsO33-(aq)+I2(aq)+2OH-(aq)![]() AsO43-(aq)+2I-(aq)+H2O(l),溶液中c(AsO43- 與反應時間(t)的關系如圖所示。下列不能判斷反應達到平衡的是
AsO43-(aq)+2I-(aq)+H2O(l),溶液中c(AsO43- 與反應時間(t)的關系如圖所示。下列不能判斷反應達到平衡的是
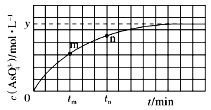
A. 溶液的pH不再變化
B. 2v正(I-)=v逆(AsO33-)
C. c(AsO43-)/c(AsO33-)不再變化
D. c(I-)=2ymol·L-1
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】M是降低潤滑油凝固點的高分子有機化合物,其結構簡式為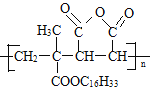 ,用石油裂解氣合成M的路線圖如圖:
,用石油裂解氣合成M的路線圖如圖:
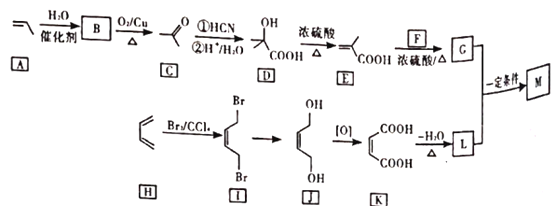
回答下列問題:
(1)B的化學名稱為______。
(2)F的分子式為_____。
(3)G中官能團的名稱是_____,G與L在一定條件下生成M的反應類型為____。
(4)I→J的反應方程式為_____。
(5)寫出2種符合條件的C的同分異構體的結構簡式____。(核磁共振氫譜為三組峰,峰面積比為3:2:1;已知雙鍵和羥基相連時物質不穩定)
(6)設計由苯乙烯為起始原料制備![]() 的合成路線(無機試劑任選)____。
的合成路線(無機試劑任選)____。
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com