
【題目】弱電解質的電離平衡、鹽類的水解平衡和難溶物的溶解平衡均屬于化學平衡。
I.已知H2A在水中存在以下平衡:H2A![]() H++HA-,HA-
H++HA-,HA-![]() H++A2-。
H++A2-。
⑴NaHA溶液__________(選填“顯酸性”、“顯堿性”、“顯中性”或“無法確定”)。
⑵某溫度下,0.1 mol/L的NaHA溶液,下列關系中,一定正確的是___________。
A.c(H+)·c(OH-)=1×10―14
B.c(Na+)+c(H+)=c(HA-)+2c(A2-)
C.c(Na+)>c(HA-)>c(A2-)>c(H2A)
D.c(Na+)=c(HA-)+c(A2-)+c(H2A)
⑶已知常溫下,H2A的鈣鹽(CaA)飽和溶液中存在以下平衡:
CaA(s)![]() Ca2+(aq)+A2-(aq) △H>0。
Ca2+(aq)+A2-(aq) △H>0。
①降低溫度時,Ksp_______(填“增大”、“減小”或“不變”,下同)。
②滴加少量濃鹽酸,c(Ca2+)__________。
③測得25℃時,CaA的Ksp為2.0×10-11,常溫下將10 g CaA固體投入100 mL CaCl2溶液中,充分攪拌后仍有固體剩余,測得溶液中c(Ca2+)=0.1 mol/L,則溶液中c(A2-)= _________mol/L
II.工業廢水中常含有一定量的Cr2O72-和CrO42-,它們會對人類及生態系統產生很大的傷害,必須進行處理。常用的處理方法有還原沉淀法,該法的工藝流程為:
CrO42-![]() Cr2O72-
Cr2O72-![]() Cr3+
Cr3+![]() Cr(OH)3
Cr(OH)3
其中第①步存在平衡:2CrO42-(黃色)+2H+![]() Cr2O72-(橙色)+H2O
Cr2O72-(橙色)+H2O
(1)若平衡體系的pH=2,則溶液顯 色.
(2)第②步中,還原1mol Cr2O72-離子,需要________mol的FeSO4·7H2O。
(3)第③步生成的Cr(OH)3在溶液中存在以下沉淀溶解平衡:
Cr(OH)3(s)![]() Cr3+(aq)+3OH-(aq)
Cr3+(aq)+3OH-(aq)
常溫下,Cr(OH)3的溶度積Ksp=c(Cr3+)·c3(OH-)=10-32,要使c(Cr3+)降至10-5mol/L,溶液的pH應調至 。
【答案】
Ⅰ.(1)無法確定;(2)D
(3)①減小;②增大;③2.0×10-10;
Ⅱ.(1)橙色;(2)6mol;(3)5;
【解析】
試題分析:I.⑴NaHA溶液中存在HA-的電離和水解平衡,大小程度無法判斷,因此溶液的酸堿性無法確定,故答案為:無法確定;
⑵A.溫度未知,c(H+)·c(OH-)不一定等于1×10―14,錯誤;B.根據電荷守恒,c(Na+)+c(H+)=c(HA-)+2c(A2-)+ c(OH-),錯誤;C.HA-的電離和水解程度大小無法判斷, c(HA-) 與c(A2-)的大小無法判斷,錯誤;D.根據物料守恒,c(Na+)=c(HA-)+ c(A2-)+ c(H2A),正確;故選D;
⑶①降低溫度時,溶解度減小,Ksp減小,故答案為:減小;
②滴加少量濃鹽酸,c(A2-)減小,平衡右移,c(Ca2+)增大,故答案為:增大;
③已知溶液中c(Ca2+)=0.1mol/L,Ksp=c(Ca2+)×c(A2+)=2.0×10-11,則c(A2-)=![]() mol/L=2.0×10-10mol/L,故答案為:2.0×10-10;
mol/L=2.0×10-10mol/L,故答案為:2.0×10-10;
Ⅱ.(1)c(H+)增大,平衡2CrO42-(黃色)+2H+![]() Cr2O72-(橙色)+H2O右移,溶液呈橙色,故答案為:橙;
Cr2O72-(橙色)+H2O右移,溶液呈橙色,故答案為:橙;
(2)根據電子得失守恒:n(Cr2O72-)×6=n(FeSO47H2O)×1,n(FeSO47H2O)=![]() =6mol,故答案為:6;
=6mol,故答案為:6;
(3)當c(Cr3+)=10-5mol/L時,溶液的c(OH-)=![]() =10-9 mol/L,c(H+)═
=10-9 mol/L,c(H+)═![]() =10-5mol/L,pH=5,即要使c(Cr3+)降至10-5mol/L,溶液的pH應調至5,故答案為:5。
=10-5mol/L,pH=5,即要使c(Cr3+)降至10-5mol/L,溶液的pH應調至5,故答案為:5。


科目:高中化學 來源: 題型:
【題目】用量筒量取一定體積的液體時,若采用俯視的方法量取20ml液體,則實際量取的液體的體積比20ml ,若量筒中實際有20ml液體,而你讀數時采用了俯視的方法,則讀得的數據比20ml 。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】1mol乙烯與氯氣發生加成反應,反應完全后再與氯氣發生取代反應,整個過程中氯氣最多消耗
A. 3mol B. 4mol C. 5mol D. 6mol
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】相同碳原子數的烷烴、烯烴、炔烴,在空氣中完全燃燒生成二氧化碳和水,需要空氣量的比較中正確是( )
A.烷烴最多
B.烯烴最多
C.炔烴最多
D.三者一樣多
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】某食品廠由葡萄糖制備葡萄糖酸鈣的過程中,葡萄糖的氧化可用以下某種試劑,其中最適合的是
A.O2/葡萄糖氧化酶 B.酸性KMnO4溶液
C.新制Cu(OH)2懸濁液 D.[Ag(NH3)2]OH溶液
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】I.某燒堿樣品含有少量不與酸作用的雜質,為了測定其純度,進行以下操作:
A.在250 mL的容量瓶中準確配制250 mL燒堿溶液
B.用堿式滴定管移取25 mL燒堿溶液于錐形瓶中并滴入2滴甲基橙指示劑
C.在天平上準確稱取燒堿樣品m g,在燒杯中用蒸餾水溶解
D.將濃度為c mol·L-1的標準硫酸裝入酸式滴定管,調整液面記下開始讀數V1
E.在錐形瓶下墊一張白紙,滴定至橙色為止,記下讀數V2
就此實驗完成下列填空:
(1)正確的操作步驟的順序是(用編號字母填寫):________________。
(2)下列操作中可能使所測NaOH的質量分數偏低的是__________。
a.滴定操作中,錐形瓶殘留少量蒸餾水
b.B步操作中,裝入燒堿溶液之前未用待測液潤洗
c.D步操作中酸式滴定管在裝入標準H2SO4溶液前未用標準液潤洗
d.讀取硫酸體積時,開始時仰視讀數,結束時俯視讀數
(3)該燒堿樣品純度的計算式為______________________。
II.以下是FeSO4·7H2O的實驗窒制備流理圖。
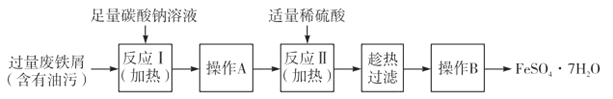
根據題意完成下列填空:
(1)反應1需要加熱數分鐘,其原因是 ;操作A為 。
(2)測定FeSO4·7H2O產品中Fe2+含量的常用方法是KMnO4溶液滴定法。已知稱取3.0g FeSO4·7H2O產品,配制成溶液,用硫酸酸化的0.01moL·L-1 KMnO4溶液滴定,消耗KMnO4溶液的體積為200.00mL。KMnO4溶液應盛裝在 滴定管中,發生反應的離子方程式為 ,計算上述樣品中FeSO4·7H2O的質量分數為 (保留兩位有效數字)。[
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】隨著大氣污染的日趨嚴重,“節能減排”,減少全球溫室氣體排放,研究NOx、SO2、CO等大氣污染氣體的處理具有重要意義。
(1)下圖是在101 kPa,298K條件下1mol NO2和1mol CO反應生成1mol CO2和1mol NO過程中的能量變化示意圖。
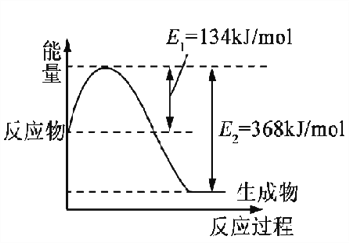
已知:① N2(g)+O2(g)=2NO(g) △H= +179.5kJ/mol
② 2NO(g)+O2(g)=2NO2(g) △H= -112.3kJ/mol
請寫出NO與CO反應生成無污染氣體的熱化學方程式: ____________________
(2)將0.20 mol NO2和0.10 mol CO充入一個容積恒定為1L的密閉容器中發生反應,在不同條件下,反應過程中部分物質的濃度變化狀況如下圖所示。
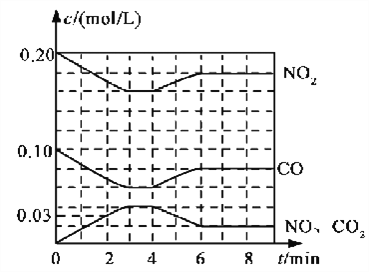
①下列說法正確的是___________(填序號)。
a.容器內的壓強不發生變化說明該反應達到平衡
b.當向容器中再充入0.20 mol NO時,平衡向正反應方向移動,K增大
c.升高溫度后,K減小,NO2的轉化率減小
d.向該容器內充入He氣,反應物的體積減小,濃度增大,所以反應速率增大
②計算產物NO在0~2 min內平均反應速率v(NO)=__________mol·L-1·min-1
③第4 min時改變的反應條件為__________________。
④計算反應在第6 min時的平衡常數K=________。若保持溫度不變,此時再向容器中充入CO、NO各0.060 mol,平衡將________移動(填“正向”、“逆向”或“不”)。
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com