
【題目】將二氧化碳轉化為乙烯的裝置如圖,使用的電極材料均為惰性電極。下列正確的是( )
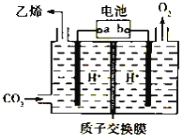
A. a為電源的正極B. 每生成0.1mol乙烯,同時生成6.72LO2
C. 電解過程中,陽極區c(H+)逐漸減小D. 陰極反應為:2CO2+12H++12e- = C2H4+4H2O
【答案】D
【解析】
電解強酸性的二氧化碳水溶液得到乙烯,二氧化碳得電子生成乙烯,電極反應式為2CO2+12H++12e-=C2H4+4H2O,為還原反應,a為電池的負極,則b為電池的正極,陽極上氫氧根失電子放出氧氣,據此分析解答。
A.由二氧化碳得電子生成乙烯,發生還原反應,所以a為電池的負極,故A錯誤;
B.陰極二氧化碳得電子生成乙烯,陽極氫氧根失電子放出氧氣,總反應為:2CO2+2H2O=C2H4+3O2,每生成0.1mol乙烯,同時生成0.3molO2,但溫度壓強不知,不能計算生成氧氣的體積,故B錯誤;
C.陽極氫氧根失電子放出氧氣,陽極區c(H+)增大,故C錯誤;
D.由二氧化碳得電子生成乙烯,發生還原反應,電極反應式為2CO2+12H++12e-=C2H4+4H2O,故D正確;
故選D。


科目:高中化學 來源: 題型:
【題目】下列離子方程式正確的是
A. 澄清石灰水與過量碳酸氫鈉溶液反應:![]() +Ca2++OH﹣=CaCO3↓+H2O
+Ca2++OH﹣=CaCO3↓+H2O
B. 硫酸氫鈉溶液中加入氫氧化鋇溶液至中性:H++![]() +Ba2++OH﹣=BaSO4↓+2H2O
+Ba2++OH﹣=BaSO4↓+2H2O
C. 向氫氧化鈉溶液中通入足量CO2:2OH﹣+CO2=![]() +H2O
+H2O
D. 向氫氧化鋇溶液中加入過量硫酸:2H++![]() +Ba2++2OH﹣=BaSO4↓+2H2O
+Ba2++2OH﹣=BaSO4↓+2H2O
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】用NA表示阿伏加德羅常數的值,下列說法中正確的是( )
A.4.0g金屬鈣變成鈣離子時失去的電子數為0.1NA
B.46gNO2和N2O4的混合氣體含有的原子數為3NA
C.3.01×1023個氮分子中含有的原子數為2NA
D.0.1molOH-中含有的電子數為0.9NA
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】經研究發現白蟻信息素有:A. ![]() ; B.
; B. ![]() ;家蠶的信息素為:CH3(CH2)2CH=CH-CH=CH(CH2)8CH3。試回答下列問題:
;家蠶的信息素為:CH3(CH2)2CH=CH-CH=CH(CH2)8CH3。試回答下列問題:
(1)下列說法正確的是________(填序號)。
A.信息素A、B互為同系物
B.以上三種信息素均能使溴的四氯化碳溶液褪色
C.信息素A、B互為同分異構體
D.1mod家蠶信息素與1molBr2加成產物只有一種
(2)用系統命名法命名:信息素A的名稱為___________________;信息素B與氫氣加成產物的名稱為_____________________________。
(3)烯烴C是信息素A的一種同分異構體,C與足量氫氣加成得到烷烴D,D的一氯代物只有2種,則D的結構簡式為_________________________________。
(4)寫出信息素B與溴水發生反應的化學方程式________________________________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】鋅銅原電池裝置如圖所示,其中陽離子交換膜只允許陽離子和水分子通過,下列有關敘述不正確的是
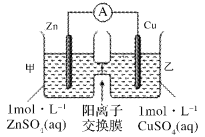
A. 該裝置中電子的流動方向為:銅電極→鋅電極
B. 電池工作一段時間后,甲池溶液的總質量不變
C. 電池工作一段時間后,乙池的c(SO42-)不變
D. 溶液中陽離子通過交換膜從負極區向正極區移動保持溶液中電荷平衡
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】稀土元素是指元素周期表中原子序數為57到71的15種鑭系元素,以及與鑭系元素化學性質相似的鈧(Sc)和釔(Y)共17種元素。稀土元素有“工業維生素”的美稱,如今已成為極其重要的戰略資源。
(1)鈧(Sc)為21號元素,基態原子電子排布式為____。
(2)離子化合物Na3[Sc(OH)6]中,存在的化學鍵除離子鍵外還有__。
(3)Sm(釤)的單質與l,2-二碘乙烷可生成乙烯:Sm + ICH2CH2I →SmI2+ CH2=CH2。
則lmol CH2=CH2中含有的σ鍵數目為___。(用NA表示阿伏伽德羅常數的值)
(4)與N3-互為等電子體的分子有___(寫其中一個的化學式即可)。
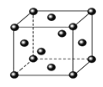
(5)Ce(鈰)單質為面心立方晶體,其晶胞參數a=516pm。Ce(鈰)原子的配位數為___,列式表示Ce(鈰)單質的密度:___g/cm3(用NA表示阿伏伽德羅常數的值,不必計算出結果)
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】請按要求回答下列問題:
(1)氮的氧化物是大氣污染物之一,用活性炭或一氧化碳還原氮氧化物,可防止空氣污染。已知:2C(s)+O2(g)=2CO(g)△H=-22lkJ/mol,
C(s)+O2(g)=CO2(g)△H=-393.5 kJ/mol,
N2(g)+O2(g)=2NO(g)△H=+181 kJ/mol,
則:2CO(g)+2NO(g)![]() N2(g)+2CO2(g)△H=__kJ/mol;
N2(g)+2CO2(g)△H=__kJ/mol;
下列措施能夠增大此反應中NO的轉化率的是___(填字母序號)
a.增大容器的體積 b.降低溫度 c.增大CO的濃度 d.增大NO的濃度
(2)向容積為2L的密閉容器中加入活性炭(足量)和NO,發生反應C(s)+2NO(g)![]() N2(g)+CO2(g)△H=-574.5kJ/mol;NO和N2的物質的量變化如下表所示。
N2(g)+CO2(g)△H=-574.5kJ/mol;NO和N2的物質的量變化如下表所示。
物質的量/mol | T1/℃ | T2/℃ | |||||
0 | 5 min | 10 min | 15 min | 20 min | 25 min | 30 min | |
NO | 2.0 | 1.20 | 0.70 | 0.70 | 0.50 | 0.40 | 0.40 |
N2 | 0 | 0.40 | 0.65 | 0.65 | 0.75 | 0.80 | 0.80 |
①0~5min內,以NO表示的該反應速率υ(NO)=__________,該條件下的平衡常數K=___________(保留2位小數)。
②第15min后,溫度調整到T2,數據變化如上表所示,則T1___________T2(填“>”、“<”或“=”)。
(3)在化學分析中采用K2CrO4為指示劑,以AgNO3標準溶液滴定溶液中Cl-,利用Ag+與CrO42-生成磚紅色沉淀,指示到達滴定終點。當溶液中Cl-恰好沉淀完全(濃度等于1.0×10-6mol·L-1)時,溶液中c(Ag+)為__mol·L-1,此時溶液中c(CrO42-)等于____mol·L-1。(已知Ksp(Ag2CrO4)=2.0×10-12,Ksp(AgCl)=2.0×10-10)。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】如圖所示原電池裝置中,電解質溶液為硫酸,下列有關敘述錯誤的是
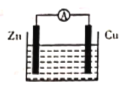
A. 鋅做負極發生氧化反應
B. 供電時的總反應為Zn+2H+=Zn2++H2↑
C. 該裝置可實現化學能轉化為電能
D. 正極產生1 mol H2,消耗鋅的質量為32.5 g
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列有關熱化學方程式的敘述中,正確的是( )
A. 含20.0gNaOH的稀溶液與足量的稀硫酸完全中和,放出28.7kJ的熱量,則表示中和熱的熱化學方程式為2NaOH(aq)+H2SO4(aq)=Na2SO4(aq)+2H2O(l) △H=-114.8kJ·mol-1
B. 已知熱化學方程式:SO2(g)+![]() O2(g)
O2(g)![]() SO3(g) △H=-98.32kJ·mol-1,在容器中充入2molSO2和1molO2充分反應,最終放出的熱量為196.64kJ
SO3(g) △H=-98.32kJ·mol-1,在容器中充入2molSO2和1molO2充分反應,最終放出的熱量為196.64kJ
C. 已知2H2(g)+O2(g)=2H2O(g) △H=-483.6kJ·mol-1,則H2的燃燒熱為241.8kJ·mol-1
D. 已知石墨轉化為金剛石為吸熱,那么石墨比金剛石穩定
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com