
【題目】以乙烯為主要原料,可以合成A、C、E等物質,其合成路線如圖所示(部分反應條件、原料、產物已略去)。
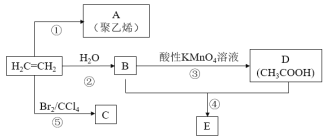
請回答下列問題:
(1)A的結構簡式為______________。
(2)反應④的化學反應類型為___________________。
(3)反應⑤的化學方程式為_________________________________________________。
 初中暑期銜接系列答案
初中暑期銜接系列答案科目:高中化學 來源: 題型:
【題目】25℃時,向25ml氫氧化鈉標準溶液中逐滴加入0.2mol·L1的一元酸HA溶液,PH變化曲線如下圖所示:
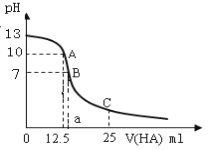
(1)該氫氧化鈉溶液的物質的量濃度為__________mol·L1。
(2)A點對應酸的體積為12.5ml,則所得混合溶液中由水電離出的c(OH)= _______mol·L1。
(3)HA是____酸(選填“強”、“弱”)。
(4) 在B點所得混合溶液中,c(Na+)、c(A)、c(H+)、c(OH) 的大小的順序是_____________。
(5)在C點所得混合溶液中,下列說正確的是________。
A.HA的電離程度小于NaA的水解程度
B.離子濃度由大到小的順序是c(Na+)>c(A)>c(H+)>c(OH)
C.c(Na+) + c(H+) = c(A-) + c(OH)
D.c(HA) + c(A) = 0.2mol·L1
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】實驗室用鎂還原硝基苯制取反式偶氮苯。實驗原理如下:
2![]() +4Mg+8CH3OH→
+4Mg+8CH3OH→![]() +4Mg(OCH3)2+4H2O
+4Mg(OCH3)2+4H2O
已知:①Mg(OCH3)2在水中極易水解。
②反式偶氮苯產品在紫外線照射后部分轉化為順式偶氮苯。
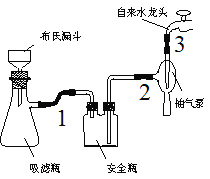
⑴在反應裝置中,加入原料及溶劑,攪拌下加熱回流。反應加入的鎂條應用砂紙打磨干凈的的原因是___________。
⑵反應結束后將反應液倒入冰水中,用乙酸中和至中性,即有反式偶氮苯粗產品析出,抽濾,濾渣用95%乙醇水溶液重結晶提純。
①為了得到較大顆粒的晶體,加入乙酸時需要___________(填“緩慢加入”、“快速加入”)。
②燒杯中的反式偶氮苯轉入布氏漏斗時,杯壁上往往還粘有少量晶體,需選用液體將杯壁上的晶體沖洗下來后轉入布氏漏斗,下列液體最合適的是___________。
A.冰水 B.飽和NaCl溶液
C.95%乙醇水溶液 D.濾液
③抽濾完畢,應先斷開___________之間的橡皮管,以防倒吸。
④重結晶操作包括“加熱溶解、趁熱過濾、冷卻結晶、抽濾、洗滌、干燥”。上述重結晶過程中的___________操作除去了不溶性雜質。
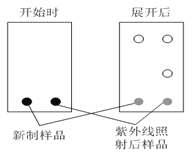
⑶薄層色譜分析中,極性弱的物質,在溶劑中擴散更快。某同學采用薄層色譜分析所得偶氮苯,實驗開始時和展開后的斑點如圖所示,則反式偶氮苯比順式偶氮苯的分子極性___________(填“強”或“弱”)。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】廢舊鋅錳電池含有鋅、錳元素,主要含有ZnO、ZnMn2 O4、MnO、Mn2 O3、Mn3 O4、MnO2。利用廢舊鋅錳電池回收鋅和制備二氧化錳、硫酸的工藝流程如圖:
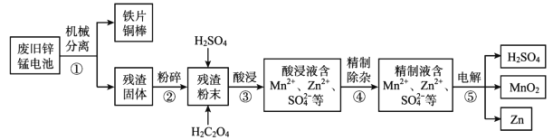
回答下列問題:
(1)步驟②“粉碎”的主要目的是______。
(2)步驟③“酸浸”發生了一系列反應:
ZnO+ H2SO4= ZnSO4 + H2O;MnO+ H2SO4= MnSO4 + H2O;
ZnMn2O4+2H2SO4=ZnSO4 + MnSO4 +2H2O+MnO2;
MnO2 + H2SO4 + H2C2O4=MnSO4 + 2CO2 ↑+2H2O。
推測 Mn2O3 與硫酸反應的離子方程式為______。
(3)如圖分別表示“酸浸”時選用不同濃度硫酸和草酸對 Zn、Mn 浸出率的影響。
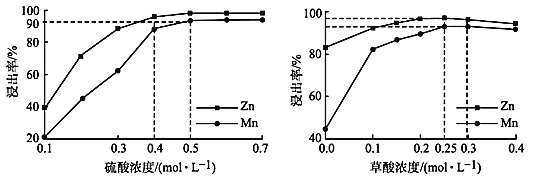
①為保證 Zn、Mn 的浸出率均大于 90%,步驟③需控制的 c(H2SO4) = ____mol/L。H2C2O4 濃度對 Mn 的浸出率影響程度大于 Zn,其原因是_____。
②假設“酸浸”所得溶液中Zn2+、Mn2+濃度相等。當 c(H2C2O4)>0.25 mol/L 時,Zn、Mn 的浸出率反而下降、且Zn 的浸出率下降先于Mn,其原因可能是_____(填序號)。
a.隨著反應進行 c(H+)降低
b.Zn2+、Mn2+與 C2O42- 生成沉淀
c.溶解度:ZnC2O4<MnC2O4
(4)步驟⑤用惰性電極電解 ZnSO4 、MnSO4 的混合溶液,除生成 Zn、MnO2、H2SO4 外, 還可能生成 H2、O2 或其混合物。
①生成 MnO2 的電極反應式為_____ 。
②若 n (H2) :n (O2)=2:1,則參加反應的 n (Zn2+):n (Mn2+) = ______。
③該工藝流程中可循環利用的物質是________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】2019年是元素周期表誕生150周年,元素周期表在學習、研究和生產實踐中有很重要的作用。①~⑥六種元素在元素周期表中的位置如下:
族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA |
1 | ① | ||||||
2 | ② | ③ | |||||
3 | ④ | ⑤ | ⑥ |
請回答下列問題:
(1)⑥的元素符號為___________。
(2)由①③④形成的化合物是一種強堿,其化學式____________。
(3)由①②形成的最簡單化合物的分子模型為_____________(填序號)
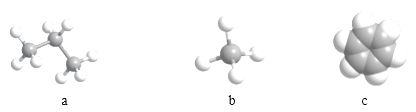
(4)⑤和⑥兩種元素的最高價氧化物對應的水化物之間反應的離子方程式為________________________________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列關于氯堿工業的說法中,正確的是( )
A.用離子交換膜法制燒堿可獲得較純凈的產品,且不會對環境造成污染
B.總的離子方程式為2Cl-+2H2O=Cl2↑+2OH-+H2↑
C.當陽極附近有0.8mol NaOH生成時,導線中就有0.8mol電子通過
D.電解飽和食鹽水可生產鹽酸,也可以生產“84”消毒液
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】有關離子交換法軟化硬水的下列敘述中,正確的是( )
A.磺化煤能使具有永久硬度的水軟化,是因為它能除去水中的Ca2+、Mg2+、S![]() 和Cl-等
和Cl-等
B.經磺化煤軟化處理后,軟水中Na+濃度增大
C.磺化煤使硬水軟化以及磺化煤的再生,這兩種操作可以在同一離子交換柱中同時進行
D.失去軟化硬水能力的磺化煤,不可能恢復它的軟化能力
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】物質的類別和核心元素的化合價是研究物質性質的兩個基本視角。根據下圖,完成下列填空:
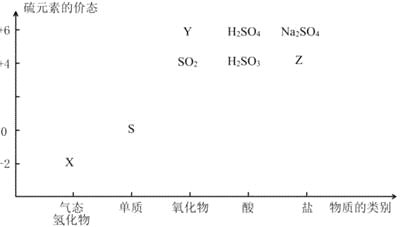
(1)上圖中X的電子式為_________;其水溶液長期在空氣中放置容易變渾濁,用化學方程式表示該變化__________;該變化體現出硫元素的非金屬性比氧元素______(填“強”或“弱”)。用原子結構解釋原因____________。
(2)Na2S2O3是一種用途廣泛的鈉鹽。下列物質用于Na2S2O3的制備,從氧化還原反應的角度,理論上有可能的是______(填字母序號)。
a.Na2S+ S b.Z+ S c.Na2SO3 + Y d.NaHS + NaHSO3
(3)SO2是主要大氣污染物之一。工業上煙氣脫硫的方法之一是用堿液吸收,其流程如圖: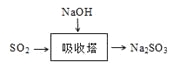 。
。
該法吸收快,效率高。若在操作中持續通入含SO2的煙氣,則最終產物為________。室溫下,0.1mol/L①亞硫酸鈉 ②亞硫酸氫鈉 ③硫化鈉 ④硫氫化鈉的四種溶液的pH由大到小的順序是________(用編號表示)。
已知:H2S:Ki1=1.3×10-7 Ki2=7.1×10-15 H2SO3:Ki1=1.3×10-2 Ki2=6.2×10-8
(4)治理含CO、SO2的煙道氣,也可以將其在催化劑作用下轉化為單質S和無毒的氣體:2CO(g) + SO2(g)![]() S(s) + 2CO2(g)。一定條件下,將CO與SO2以體積比為4∶1置于恒容密閉容器中發生上述反應,下列選項能說明反應達到平衡狀態的是______(填寫字母序號)。
S(s) + 2CO2(g)。一定條件下,將CO與SO2以體積比為4∶1置于恒容密閉容器中發生上述反應,下列選項能說明反應達到平衡狀態的是______(填寫字母序號)。
a.υ (CO) ∶υ(SO2) = 2∶1 b.平衡常數不變
c.氣體密度不變 d.CO2和SO2的體積比保持不變
測得上述反應達平衡時,混合氣體中CO的體積分數為![]() ,則SO2的轉化率為________。
,則SO2的轉化率為________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】高氯酸銨(NH4ClO4)可用作火箭推進劑等。制備NH4ClO4的工藝流程如下:
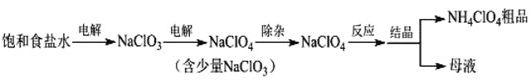
(1)電解NaClO3溶液時,ClO3-在____極發生反應,其電極反應式為____。
(2)“除雜”有兩種方案。
①方案1:加入鹽酸和H2O2溶液,NaClO3轉化為ClO2,化學方程式為______。
方案2:加入氨水和FeCl24H2O,NaClO3轉化為Cl-,離子方程式為____,如果FeCl24H2O過量會出現黑色磁性沉淀,該沉淀可能是______。(填化學式)
②比較氧化性:ClO3-_____ClO4-(填“>”或“<”)。
③兩種方案相比,方案1的優點是____。(答一條即可)
(3)“反應”時用NaClO4和NH4Cl在90℃制備NH4ClO4。如果用濃鹽酸和液氨代替NH4Cl,則無需加熱,原因是____。
(4)該流程中可循環利用的物質是_________。(填化學式)
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com