
【題目】隨原子序數的遞增,八種短周期元素的原子半徑的相對大小、最高正價或最低負價的變化如下圖所示,下列分析正確的是( )
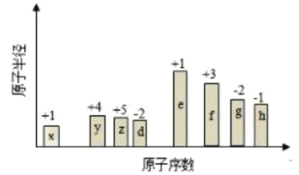
A.![]() 、
、![]() 的簡單離子半徑大小:
的簡單離子半徑大小:![]()
B.元素的金屬性:![]()
C.元素的非金屬性:![]()
D.![]() 、
、![]() 、
、![]() 和
和![]() 四種元素能形成離子化合物
四種元素能形成離子化合物
 名校課堂系列答案
名校課堂系列答案科目:高中化學 來源: 題型:
【題目】原子序數為x的元素E在周期表中位于A、B、C、D四種元素中間(如圖所示),則A、B、C、D四種元素的原子序數之和不可能是(鑭系、錒系、0族元素除外)( )
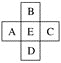
A. 4xB. 4x+14
C. 4x+10D. 4x+6
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】以不同類別物質間的轉化為線索,認識鈉及其化合物。
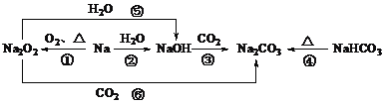
下列分析不正確的是
A.反應③表明CO2具有酸性氧化物的性質
B.反應④說明NaHCO3的穩定性強于Na2CO3
C.反應⑤、⑥可用于潛水艇中氧氣的供給
D.上述轉化中發生的反應有分解反應、化合反應、置換反應
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】現在含有生命元素硒(![]() )的保健品已經進入市場,已知硒與氧同族,與鉀同周期,則下列關于硒的敘述中正確的是( )
)的保健品已經進入市場,已知硒與氧同族,與鉀同周期,則下列關于硒的敘述中正確的是( )
A.硒單質在常溫下是固體
B.硒的氣態氫化物穩定性比![]() 強
強
C.硒是金屬元素
D.硒酸(![]() )的酸性比硫酸強
)的酸性比硫酸強
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】有MgCl2、Al2(SO4)3的混合溶液,向其中不斷加入NaOH溶液,得到的沉淀量與加入的NaOH溶液的關系如圖所示,則溶液中c(Cl—)與c(SO42—)之比為( )

A. 1∶1 B. 2∶3 C. 3∶2 D. 2∶1
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】“索爾維制堿法”工藝流程如圖所示,請回答下列問題:
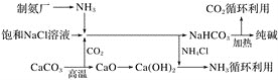
(1)向飽和氯化鈉溶液中先通入___,效果更好。反應制得NaHCO3沉淀和NH4Cl溶液的化學方程式為____。
(2)索爾維制堿法除了得到純堿外,還會產生一種廢渣___。侯氏制堿法在此工藝上改進,不再使用碳酸鈣制備CO2,而是在制備NH3的過程中制得CO2,則侯氏制堿法在得到純堿的同時還制得了___,此物質在農業上的用途是___。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】鋁、鐵是常見的金屬,其化合物也有廣泛的用途。回答下列問題:
(1)氫氧化鋁是一種兩性氫氧化物,寫出它的電離方程式___,將少量的稀鹽酸逐漸滴入NaAlO2溶液,產生的現象為___,用平衡移動原理來解釋這一現象:___。
(2)明礬可以用于凈水,用離子反應方程式來解釋原理:___,將Ba(OH)2溶液滴入明礬溶液中,當SO42-完全沉淀,則鋁元素在溶液中存在的形式為___(用化學式表示)。
(3)高鐵酸鈉(Na2FeO4)可用作高效水處理劑,既可以殺菌消毒,又可以除去水中的懸浮顆粒物,請用你所學過的化學原理加以解釋。___。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列指定反應的離子方程式正確的是( )
A.Na2O2與H2O反應:2O![]() +2H2O===O2↑+4OH-
+2H2O===O2↑+4OH-
B.向Fe2(SO4)3溶液中加入足量Cu粉:2Fe3++3Cu===2Fe+3Cu2+
C.向NaHSO4溶液中加入Ba(OH)2溶液至中性:2H++SO![]() +Ba2++2OH-===BaSO4↓+2H2O
+Ba2++2OH-===BaSO4↓+2H2O
D.向銀氨溶液中加入足量鹽酸:[Ag(NH3)2]++2H+===Ag++2NH![]()
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】T℃時,在1L的密閉容器中充入1molCO2和3molH2,發生反應:CO2(g)+3H2(g) ![]() CH3OH(g)+H2O(g)H=-49.0kJ·mol-1,測得CO2和CH3OH(g)的濃度隨時間變化曲線如圖所示。下列敘述中,正確的是( )
CH3OH(g)+H2O(g)H=-49.0kJ·mol-1,測得CO2和CH3OH(g)的濃度隨時間變化曲線如圖所示。下列敘述中,正確的是( )
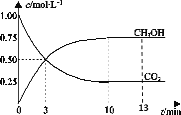
A.T℃時,平衡常數K=3,CO2與H2的平衡轉化率相等
B.T℃時,上述條件下達到平衡時放出49.0kJ的熱量
C.降溫和縮小容器體積均可使反應的平衡常數增大
D.從反應開始到3min,H2的平均反應速率υ(H2)=0.5molL-1min-1
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com