
【題目】I.一定量的CO(g)和H2O(g)分別通入容積為1L的恒容密閉容器中,發生反應CO(g)+H2O![]() CO2(g)+H2(g)得到如下三組數據:
CO2(g)+H2(g)得到如下三組數據:
實驗組 | 溫度℃ | 起始量/mol | 平衡量/mol | 達到平衝所需時間/min | ||
CO | H2O | CO2 | ||||
1 | 500 | 8 | 4 | 3.2 | 4 | |
2 | 700 | 4 | 2 | 0.8 | 3 | |
3 | 700 | 4 | 2 | 0.8 | 1 | |
(1)下列情況表明反應達到平衡狀態的是________(填序號)
A. CO2和H2生成速率相等
B.溫度不變時,壓強不變
C.生成CO2的速率和生成CO的速率相等
(2)實驗2中,反應達到平衡狀態時,CO的轉化率為__________。
(3)實驗3和實驗2相比,改變的條件是_____________。
II.(1)硫化鈉溶液具有較強堿性,其原因是___________(用離子方程式表示)。
(2)欲使0.1mol的Na2S溶液中, 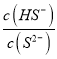 的值增大,可采取的措施是___________(填序號)
的值增大,可采取的措施是___________(填序號)
A.加適量等濃度的NaOH溶液
B.加適量的水
C.通入適量的H2S氣體
【答案】 C 20% <span style="color: rgb(169, 68, 66); font-size: 12px; background-color: rgb(245, 245, 245);">加催化劑或加壓</span> S2- + H2OHS- + OH- HS- + H2OH2S + OH- BC
【解析】I.(1)考查化學平衡狀態的判斷,A、用化學反應速率表示達到平衡,要求反應方向一正一逆,且反應速率之比等于化學計量數之比,生成CO2和H2反應都是向正反應方向進行,因此當兩者相等時,不能表示反應達到平衡,故A錯誤;B、組分都是氣體,且反應前后氣體系數之和相等,因此壓強始終保持不變,所有反應不是吸熱反應就是放熱反應,因此當溫度不變,說明反應達到平衡,故B錯誤;C、根據A選項的分析,故C正確;(2)考查化學平衡的計算,達到平衡,CO2的物質的量為0.8mol,則消耗CO的物質的量為0.8mol,因此CO的轉化率為0.8/4×100%=20%;(3)溫度相同,起始量相同,達到平衡時,CO2的量相同,說明平衡沒有移動,但化學反應速率加快,改變條件是使用催化劑或增大壓強;II.(1)考查水解方程式的書寫,Na2S屬于強堿弱酸鹽,S2-發生水解,即S2-+H2O![]() HS-+OH-;(2)考查影響鹽類水解的因素,A、加入NaOH,c(OH-)增大,抑制S2-的水解,n(HS-)減少,n(S2-)增大,因為是同溶液中,體積相同,因此比值降低,故A錯誤;B、加水,促進鹽類水解,n(HS-)增大,n(S2-)降低,因此比值增大,故B正確;C、發生Na2S+H2S=2NaHS,n(HS-)增大,n(S2-)減小,因此比值增大,故C正確。
HS-+OH-;(2)考查影響鹽類水解的因素,A、加入NaOH,c(OH-)增大,抑制S2-的水解,n(HS-)減少,n(S2-)增大,因為是同溶液中,體積相同,因此比值降低,故A錯誤;B、加水,促進鹽類水解,n(HS-)增大,n(S2-)降低,因此比值增大,故B正確;C、發生Na2S+H2S=2NaHS,n(HS-)增大,n(S2-)減小,因此比值增大,故C正確。


科目:高中化學 來源: 題型:
【題目】下圖是部分金屬和非金屬材料發現和使用的時間簡軸。請回答:
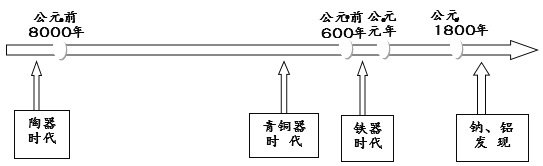
(1)我國最早使用的合金是_________;
(2)Cu、Fe、Na、Al四種金屬元素中,金屬性最強的是_______(填元素符號);
Al的原子結構示意圖是________________________;
(3)我國西漢時期就開始冶煉銅,古人有“曾青得鐵則化為銅”的記載,是現代“濕法煉銅”的先驅,請寫出上述反應的化學方程式:____________________________;
(4)19世紀初,鈉和鋁的發現得益于電解技術的應用。
冶煉鋁的原料Al2O3屬于_____氧化物(選填“酸性”、“堿性”或“兩性”);冶煉鋁的反應為:2 Al2O3(熔融)![]() 4Al +3O2↑ ,反應中生成1molAl轉移電子_________mol。
4Al +3O2↑ ,反應中生成1molAl轉移電子_________mol。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】某有機物A由C、H、O三種元素組成,相對分子質量為90。將9.0 g A完全燃燒的產物依次通過足量的濃硫酸和堿石灰,分別增重5.4 g和13.2 g。A能與NaHCO3溶液發生反應,且2分子A之間脫水可生成六元環化合物。有關A的說法正確的是 ( )
A. 分子式是C3H8O3 B. A催化氧化的產物能發生銀鏡反應
C. 0.1 mol A與足量Na反應產生2.24 L H2(標準狀況) D. A在一定條件下發生縮聚反應的產物是![]()
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】已知反應:2CH3COCH3(l)![]() CH3COCH2COH(CH3)2(l)。取等量CH3COCH3,分別在0℃和20℃下,測得其轉化分數(反應物已轉化為產物的物質的量和反應物總物質的量的比)隨時間變化的關系曲線(Y-t)如下圖所示。下列說法正確的是
CH3COCH2COH(CH3)2(l)。取等量CH3COCH3,分別在0℃和20℃下,測得其轉化分數(反應物已轉化為產物的物質的量和反應物總物質的量的比)隨時間變化的關系曲線(Y-t)如下圖所示。下列說法正確的是

A. b代表0℃下CH3COCH3的Y-t曲線
B. 反應進行到20min末,CH3COCH3的v (0℃)/v(20℃)的比值大于1
C. 升高溫度可以縮短反應達到平衡的時間并能提高反應物轉化為生成物的物質的量
D. 從Y=0到Y=0.113,CH3COCH2COH(CH3)2的Δn(0℃)/Δn(20℃)的比值等于1
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】關于溶液的下列說法正確的是
A. 等體積、等物質的量濃度的NaX和弱酸HX混合后的溶液中:C(Na+)>c(HX)>c(X-)>c(H+)>c(OH-)
B. 等物質的量濃度的下列溶液:①H2CO3②Na2CO3③NaHCO3④(NH4)2CO3中c(CO32-)的大小關系為:②>④>③>①
C. 往0.lmol/L HCOOH溶液中通入少量HCl氣體,甲酸的電離平衡向逆反應方向移動,且溶液中![]() 增大
增大
D. Na2CO3溶液中,2c(Na+)=c(CO32-)+c(HCO3-)+c(H2CO3)
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】在我國,使用最早的合金是_________。目前用量最大、用途最廣的合金是_________,根據其化學成分,可分為_________和_________兩大類。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】【上海市閔行區2017屆高三上學期期末教學質量調研(一模)】
利用海水可以提取氯化鈉、溴、碘等產品。海帶提碘的流程如下:
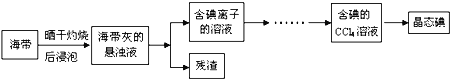
(1)CCl4含有___________鍵的______________分子(均選填“極性”或“非極性”)。
(2)灼燒海帶時除需要三腳架、酒精燈、泥三角外,還需要的主要儀器是____________。
(3)為更好的完成實驗,灼燒海帶時,需加入一定量的氫氧化鈉充分混合后再灼燒。此操作目的是___________________________________。
(4)向盛有碘離子溶液中加入CCl4和氯水,______(填:“上”或“下”)層呈紫紅色;如果氯水加過量,CCl4層會由紫紅色變成無色。整個過程中被氧化的微粒是__________________。寫出并配平CCl4層由紫紅色變成無色的化學反應方程式:__________
![]()
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】除去下列物質中的雜質(括號中為雜質),采用的試劑和除雜方式正確的是
選項 | 含雜質的物質 | 試劑 | 除雜方法 |
A | CH4(C2H4) | 酸性高錳酸鉀溶液 | 洗氣 |
B | C6H6(C6H6OH) | 溴水 | 分液 |
C | C6H5NO2(HNO3) | NaOH溶液 | 分液 |
D | C2H5OH(H2O) | 金屬鈉 | 過濾 |
A. A B. B C. C D. D
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com