
【題目】已知X、Y和Z三種元素的原子序數之和等于48。X的一種1∶1型氫化物分子中既有σ鍵又有π鍵。Z是金屬元素,Z的單質和化合物廣泛的用途。已知Z的核電荷數小于28,且次外層有2個未成對電子。工業上利用ZO2和碳酸鋇在熔融狀態下制取化合物M(M可看做一種含氧酸鹽)。M有顯著的“壓電性能”,應用于超聲波的發生裝置。經X射線分析,M晶體的最小重復單元為正方體(如圖),邊長為4.03×10-10 m,頂點位置為Z4+所占,體心位置為Ba2+所占,所有棱心位置為O2-所占。
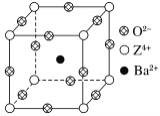
(1) Y在周期表中位于______________;Z4+的核外電子排布式為___________________。
(2)X的該種氫化物分子構型為________,X在該氫化物中以_______方式雜化。X和Y形成的化合物的熔點應該_______(填“高于”或“低于”)X氫化物的熔點。
(3)①制備M的化學方程式是_____________。
②在M晶體中,若將Z4+置于正方體的體心,Ba2+置于正方體的頂點,則O2-處于正方體的________。
③在M晶體中,Z4+的氧配位數為________。
④已知O2-半徑為1.40×10-10 m,則Z4+半徑為____ m。
 口算心算速算應用題系列答案
口算心算速算應用題系列答案 同步拓展閱讀系列答案
同步拓展閱讀系列答案科目:高中化學 來源: 題型:
【題目】實驗室常用熱的氫氧化鈉溶液洗去試管內壁沾有的硫單質,發生反應6NaOH+3S![]() 2Na2S+Na2SO3+3H2O。關于該反應的說法不正確的是( )
2Na2S+Na2SO3+3H2O。關于該反應的說法不正確的是( )
A. 硫既是氧化劑又是還原劑 B. 硫化鈉是還原產物
C. 硫既表現氧化性又表現還原性 D. 消耗3 mol 硫,轉移電子6 mol
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】(Ⅰ)A、B、C、D、E五種元素在周期表里的位置如下表所示:
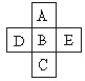
A、B、C為同主族元素,A為該族中原子半徑最小的元素;D、B、E為同周期元素,E為該周期中原子半徑最小的元素。D元素名稱是____,在周期表第___周期,第______族,其原子結構示意圖______。
(Ⅱ)A、B、C、D、E、F六種短周期元素的原子序數依次增大。已知A、C、F三原子的最外層共有11個電子,且這三種元素的最高價氧化物的水化物之間兩兩皆能反應,均生成鹽和水,D元素原子的最外層電子數比次外層電子數少4個,E元素原子的次外層電子數比最外層電子數多3個。試回答:
(1)寫出下列元素的符號A_____,D_____,E_____。
(2)A、C兩種元素最高價氧化物的水化物之間反應的離子方程式________________________________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下表是元素周期表的一部分,請回答有關問題:
| ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
2 | ① | ② | ③ | |||||
3 | ④ | ⑤ | ⑥ | ⑦ | ⑧ | |||
4 | ⑨ | ⑩ |
(1)表中化學性質最不活潑的元素,其原子結構示意圖為 ________ ;
(2)表中能形成兩性氫氧化物的元素是 ________ (用元素符號表示),寫出該元素的單質與⑨最高價氧化物的水化物反應的化學方程式:_________;
(3)③⑦⑩三種元素的陰離子還原性順序為: _________________;⑦單質的水溶液呈__________色;
(4)①、②、⑥、⑦四種元素的最高價氧化物的水化物中酸性最強的是 _______(填物質化學式) ;(提示:同周期元素,從左到右非金屬性逐漸增強。)
(5)③元素與⑩元素兩者核電荷數之差是 ____________ ;
(6)設計實驗方案:比較⑦與⑥單質氧化性的強弱,請將方案填入下表。
實驗步驟 | 實驗現象與結論 |
____________________ | ____________________ |
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】某原電池裝置如圖所示,電池總反應為2Ag+Cl2=2AgCl。下列說法正確的是

A. 正極反應為AgCl +e-=Ag +Cl-
B. 放電時,交換膜右側溶液中有大量白色沉淀生成
C. 若用NaCl溶液代替鹽酸,則電池總反應隨之改變
D. 當電路中轉移0.01 mol e-時,交換膜左側溶液中約減少0.02 mol離子
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】用“物質的量的單位——摩爾”計量的對象是( )
A. 商場貨品(如文具等)B. 細小物品(如米粒等)
C. 微觀粒子(如分子等)D. 只有分子、原子和離子
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】某學生用量筒量取液體,初次視線與量筒內凹液面的最低處保持水平,讀數為9.8mL。倒出部分液體后,俯視凹液面的最低處,讀數為3.5mL,則該學生實際倒出液體的體積
A. 大于6.3mLB. 小于6.3mLC. 等于6.3mLD. 無法確定
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】在元素周期表中,非金屬元素集中于右上角的位置,它們雖然種類少,但其用途卻不容小覷。
(1)元素周期表的非金屬元素中,屬于主族元素的共有________種。
(2)紅磷是巨型共價分子、無定型結構。能證明紅磷是非晶體的最可靠方法是________。
A.質譜 B.原子發射光譜 C.核磁共振譜 D.X射線衍射
(3)成語“信口雕黃”中的雌黃分子式為As2S3,分子結構如右圖。
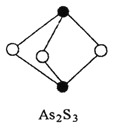
其分子中S原子的雜化方式為________。雌黃和SnCl2在鹽酸中反應轉化為雄黃(As4S4)和SnCl4并放出H2S氣體,寫出該反應的化學方程式______。
(4)已知pKa=-lgKa。
①有機酸的酸性強弱受鄰近碳上取代原子的影響,如酸性:BrCH2COOH>CH3COOH。據此推測,pKa:ClCH2COOH______FCH2COOH(填“>”、“<”、“=”)。
②硼酸(H3BO3)是一元酸,它在水中表現出來的弱酸性,并不是自身電離出H+所致,而是H3BO3與水電離出的OH-結合生成一個酸根離子,請寫出該酸根離子的結構簡式: ________(若存在配位鍵,請用箭頭標出)。
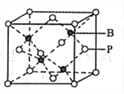
(5)磷化硼的晶胞模型如右圖所示,晶胞參數為apm,已知B、P的原子半徑分別表示為rBpm、rPpm。該晶胞中磷原子的配位數為________,晶體中原子的空間利用率為______。
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com