
【題目】常溫下,HNO2的電離平衡常數為K=4.6×10﹣4(已知 ![]() =2.14),向20mL0.01molL﹣1的HNO2溶液中逐滴加入相同濃度的NaOH溶液,測得混合液的pH隨NaOH溶液體積的變化如圖所示,下列判斷正確的是( )
=2.14),向20mL0.01molL﹣1的HNO2溶液中逐滴加入相同濃度的NaOH溶液,測得混合液的pH隨NaOH溶液體積的變化如圖所示,下列判斷正確的是( ) 
A.HNO2的電離方程式為HNO2=NO2﹣+H+
B.a點H2O電離出的c(H+)=2.14×10﹣3molL﹣1
C.b點溶液中離子濃度大小關系為c(NO2﹣)>c(Na+)>c(H+)>c(OH﹣)
D.X值等于20
【答案】C
【解析】解:A.HNO2的電離平衡常數為K=4.6×10﹣4,亞硝酸為弱酸存在電離平衡,電離方程式為HNO2NO2﹣+H+,故A錯誤;
B.由HNO2H++NO2﹣,K= ![]() ≈
≈ ![]() ,4.6×10﹣4≈
,4.6×10﹣4≈ ![]() ,得到c(H+)=2.14×10﹣3mol/L,水電離出氫離子濃度遠小于酸電離出氫離子,故B錯誤;
,得到c(H+)=2.14×10﹣3mol/L,水電離出氫離子濃度遠小于酸電離出氫離子,故B錯誤;
C.b點溶液為HNO2、NaNO2混合溶液,且濃度比為1:1;由NO2﹣+H2OHNO2+OH﹣,HNO2H++NO2﹣,電離程度大于水解程度,可知溶液呈酸性,離子濃度大小為c(NO2﹣)>c(Na+)>c(H+)>c(OH﹣),故C正確;
D.向20mL0.01molL﹣1的HNO2溶液中逐滴加入相同濃度的NaOH溶液,若恰好反應需要氫氧化鈉溶液體積20,ml,C點是溶液呈中性,溶質為HNO2、NaNO2混合溶液,X<20ml,故D錯誤;
故選C.
【考點精析】關于本題考查的弱電解質在水溶液中的電離平衡,需要了解當弱電解質分子離解成離子的速率等于結合成分子的速率時,弱電解質的電離就處于電離平衡狀態;電離平衡是化學平衡的一種,同樣具有化學平衡的特征.條件改變時平衡移動的規律符合勒沙特列原理才能得出正確答案.


 智能訓練練測考系列答案
智能訓練練測考系列答案科目:高中化學 來源: 題型:
【題目】某同學想通過如圖裝置實驗,探究SO2與Na2O2反應的產物. 
(1)Ⅰ.檢驗反應中是否有O2生成的方法是;若有O2生成,請寫出裝置C中的化學方程式 . Ⅱ.A中盛裝H2SO4溶液的儀器名稱是;D裝置除起了防止空氣中的水蒸氣和二氧化碳進入C裝置與Na2O2反應作用外,還可以 .
(2)Ⅲ.①C中固體產物可能只有Na2SO3、只有、Na2SO3和Na2SO4兩種都有. ②若Na2O2反應完全,為確定C中固體產物的成分,該同學設計如下,請您利用限選試劑和儀器幫助他完成該探究過程,并將答案寫在答題卡相應位置.
限選試劑和儀器:0.1mol/LKMnO4酸性溶液、0.01mol/LKMnO4酸性溶液、0.1mol/LBa(NO3)2溶液、0.1mol/LBaCl2溶液、1mol/L HNO3溶液、1mol/L鹽酸、試管、膠頭滴管.
實驗操作 | 預期現象和結論 |
步驟一:取少量C中固體產物于試管中,加入適量的蒸餾水、攪拌溶解,分別取少量于A、B試管中. | 固體完全溶解,得到無色透明溶液 |
步驟二:取試管A,向溶液中加入 , 振蕩,觀察溶液顏色變化. | 若; |
步驟三:取試管B,向其中先加入 , 振蕩;再加入 , 振蕩. | 產生 , |
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列圖示與對應的敘述相符的是( )
A.
可表示將SO2氣體通入溴水時pH的變化
B.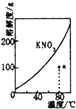
表示KNO3的溶解度曲線,a點是80℃的KNO3的不飽和溶液
C.
表示乙酸溶液中通入氨氣至過量過程中溶液導電性的變化
D.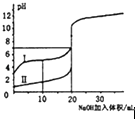
表示室溫下,0.100mol/L NaOH溶液分別滴定0.100mol/L的鹽酸和醋酸的滴定曲線,由圖知I為鹽酸的滴定曲線
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】可以由下列反應合成三聚氰胺:CaO+3C ![]() CaC2+CO,CaC2+N2
CaC2+CO,CaC2+N2 ![]() CaCN2+C,CaCN2+2H2O═NH2CN+Ca(OH)2 , NH2CN與水反應生成尿素[CO(NH2)2],尿素可進一步合成三聚氰胺.
CaCN2+C,CaCN2+2H2O═NH2CN+Ca(OH)2 , NH2CN與水反應生成尿素[CO(NH2)2],尿素可進一步合成三聚氰胺.
(1)CaCN2中陰離子為CN22﹣ , 與CN22﹣互為等電子體的分子有N2O和(填化學式),由此可以推知CN22﹣的空間構型為 .
(2)三聚氰胺( 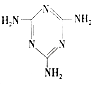 )俗稱“蛋白精”.動物攝入三聚氰胺和三聚氰酸(
)俗稱“蛋白精”.動物攝入三聚氰胺和三聚氰酸( 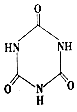 ) 后,三聚氰酸與三聚氰胺分子相互之間通過結合,在腎臟內易形成結石.
) 后,三聚氰酸與三聚氰胺分子相互之間通過結合,在腎臟內易形成結石.
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】1體積某氣態烴和2體積氯化氫發生加成反應后,最多還能和6體積氯氣發生取代反應.由此可以斷定原氣態烴是(氣體體積均在相同條件下測定)( )
A.乙炔
B.丙炔
C.丁炔
D.丁二烯
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】常溫下,0.1mol·L-1的H2A溶液中各種微粒濃度的對數值(lgc)與pH的關系如圖所示。( )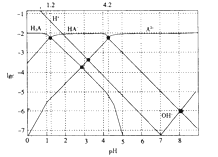
下列說法不正確的是
A.H2A是二元弱酸
B.HA-![]() H++A2-的電離平衡常數Ka=10-12
H++A2-的電離平衡常數Ka=10-12
C.0.1mol·L-1的H2A溶液中:c(H+)=c(HA-)+2c(A2-)+c(OH-)
D.pH=4.2 時:c(HA-)=c(A2-)>c(H+)>c(H2A)>c(OH-)
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】利用右圖所示裝置進行下列實驗,能得到相應實驗結論的是 ( )
選項 | ① | ② | ③ | 實驗結論 |
|
A | 濃硫酸 | Na2SO3 | KMnO4溶液褪色 | SO2有漂白性 | |
B | 濃鹽酸 | KMnO4 | FeBr2溶液變為黃色 | 氧化性:Cl2 >Br2 | |
C | 稀硫酸 | 碳酸鈉 | CaCl2溶液無明顯變化 | CO2不與CaCl2反應 | |
D | 濃硫酸 | 蔗糖 | 溴水褪色 | 濃硫酸具有脫水性、吸水性 |
A. A B. B C. C D. D
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com