
【題目】(題文)25℃時,用0.10 mol/L的氨水滴定10.00 mL 0.05 mol/L的二元酸H2A的溶液,滴定過程中加入氨水的體積(V)與溶液中 的關系如圖所示。下列說法正確的是
的關系如圖所示。下列說法正確的是

A. H2A的電離方程式為H2A![]() H++HA -
H++HA -
B. B點溶液中,水電離出的氫離子濃度為1.0×10-6 mol/L
C. C點溶液中,c(NH4+)+c(NH3·H2O)= 2c(A2-)
D. 25℃時,該氨水的電離平衡常數為![]()
【答案】B
【解析】根據圖像,A點時,0.05 mol/L的二元酸H2A的溶液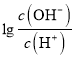 = -12,此時c(OH-)=10-12c(H+),c(OH-)=1.0×10-13 mol/L,c(H+)=0.1 mol/L,說明H2A為二元強酸。A、H2A的電離方程式為H2A=2H++A 2-,故A錯誤;B、B點溶液中,加入了10mL 0.10 mol/L的氨水,恰好完全反應,此時溶液應為(NH4)2A溶液,
= -12,此時c(OH-)=10-12c(H+),c(OH-)=1.0×10-13 mol/L,c(H+)=0.1 mol/L,說明H2A為二元強酸。A、H2A的電離方程式為H2A=2H++A 2-,故A錯誤;B、B點溶液中,加入了10mL 0.10 mol/L的氨水,恰好完全反應,此時溶液應為(NH4)2A溶液, 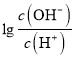 = -2,c(OH-)=10-2c(H+),c(OH-)=1.0×10-8 mol/L,c(H+)=1.0×10-6mol/L,此時溶液因NH4+水解呈酸性,溶液中的氫離子均是水電離產生的,故水電離出的氫離子濃度為1.0×10-6 mol/L,故B正確;C、C點溶液中,加入了12.5 mL 0.10 mol/L的氨水,此時溶液應為(NH4)2A和NH3·H2O混合溶液,
= -2,c(OH-)=10-2c(H+),c(OH-)=1.0×10-8 mol/L,c(H+)=1.0×10-6mol/L,此時溶液因NH4+水解呈酸性,溶液中的氫離子均是水電離產生的,故水電離出的氫離子濃度為1.0×10-6 mol/L,故B正確;C、C點溶液中,加入了12.5 mL 0.10 mol/L的氨水,此時溶液應為(NH4)2A和NH3·H2O混合溶液, 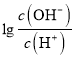 = 0,c(OH-)=c(H+),根據電荷守恒:c(NH4+)+c(H+)= 2c(A2-)+c(OH-),即c(NH4+)= 2c(A2-),故C錯誤;D、B點時,溶液應為0.025mol/L(NH4)2A溶液,
= 0,c(OH-)=c(H+),根據電荷守恒:c(NH4+)+c(H+)= 2c(A2-)+c(OH-),即c(NH4+)= 2c(A2-),故C錯誤;D、B點時,溶液應為0.025mol/L(NH4)2A溶液, 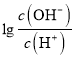 = -2,c(OH-)=10-2c(H+),c(OH-)=1.0×10-8 mol/L,c(H+)=1.0×10-6mol/L,溶液因NH4+水解呈酸性,NH4++ H2O
= -2,c(OH-)=10-2c(H+),c(OH-)=1.0×10-8 mol/L,c(H+)=1.0×10-6mol/L,溶液因NH4+水解呈酸性,NH4++ H2O![]() H++ NH3·H2O,該反應的水解常數為Kh=
H++ NH3·H2O,該反應的水解常數為Kh=![]() =
=![]() =
= ![]() =2×10-5,故氨水的電離平衡常數為
=2×10-5,故氨水的電離平衡常數為![]() =5×10-10,故D錯誤;故選B。
=5×10-10,故D錯誤;故選B。


 小學課堂作業系列答案
小學課堂作業系列答案 金博士一點全通系列答案
金博士一點全通系列答案科目:高中化學 來源: 題型:
【題目】下列各組離子中,能大量共存的一組是…………………………………………( )
A.K+、NO3-、Na+、CO32-B.Na+、Cl-、H+、HCO3-
C.Mg2+、Al3+、Cl-、OH-D.Ca+、CO32-、K+、OH-
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】鈦被譽為“21世紀的金屬”,在工農業生產、醫療、國防、科技等方面中有著極其廣泛而重要的用途。四氯化鈦是工業上制備金屬鈦的重要原料。在常溫下,它是一種極易水解的無色液體,沸點為136.4℃。工業制備TiCl4的反應原理為:TiO2+2C+2Cl2![]() =TiCl4+2CO。
=TiCl4+2CO。
下圖是實驗室模擬工業生產制備四氯化鈦的反應裝置,其主要操作步驟有(順序己打亂):
①連接好整套裝置,并檢査裝置的氣密性;
②當錐形瓶中的TiCl4的量不再增加時,停止加熱,改通CO2氣體直至電爐中的瓷管冷卻為止;
③將Ti02、炭粉混合均勻后,裝入管式電爐中;
④將電爐升溫至800℃,一段時間后改通Cl2,同時在冷凝管中通冷凝水;
⑤通入干燥的CO2氣體并持續一段時間。

試回答:
(1)儀器F的名稱是_______________,裝罝A所用的試劑名稱是_______________。
(2)正確的操作程序是(填寫操作步驟的序號)______________________________。
(3)操作⑤的目的是______________________________。
(4)裝置中冷凝管進水口的位置是(填a或b)_______________,裝置E的作用_______________。
(5)將少量TiCl4露置于空氣中,可能看到的現象是______________________________。
(6)利用化合物TiCl4可制備TiO2,請結合化學用語解釋該過程:_______________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】向200 mL FeBr2溶液中逐漸通入Cl2,其中n(Fe 3+)、n(Br2) 隨通入n(Cl2)的變化如圖所示,下列說法不正確的是( )

A.氧化性強弱:Br2 > Fe3+
B.由圖可知,該FeBr2溶液的濃度為1 mol·L-l
C.n(Cl2)=0. 12 mol時,溶液中的離子濃度有c (Fe 3+)∶c( Br-)=1∶8
D.n(FeBr2)∶n(Cl2)=1∶1時,反應的離子方程式為:2Fe2++2Br- + 2Cl2=2Fe3++Br2 + 4Cl-
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】X、Y、Z、W是原子序數依次增大的常見短周期元素,X的某種氫化物能使濕潤的紅色石蕊試紙變藍.Y的一種核素質量數為18,中子數為10.在同周期元素中Z的簡單離子半徑最小,W的單質是良好的半導體材料。下列說法中正確的是
A. 簡單氣態氫化物穩定性:W >X
B. Y元素的相對原子質量為18
C. X2H4的分子中極性鍵和非極性鍵數目比為4:l
D. 電解Z的熔融氯化物可以冶煉單質Z
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】SiCl4是一種遇水強烈水解,并放出大量的熱的化合物。研究人員利用SiCl4水解生成的鹽酸和鋇礦粉(主要成分為BaCO3,且含有鐵、鎂等離子)來制備BaCl2·2H2O,工藝流程如下:
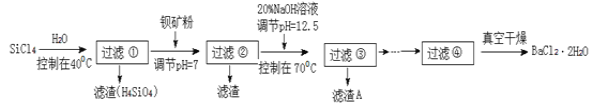
已知:①常溫下Fe3+ 、Mg2+ 完全沉淀的 pH 分別是3.4、12.4。
②Ge與Si同主族位于Si的下一周期。
(1)Ge的原子序數________
(2)請用電子式表示C2H2的形成過程_____________________________。
(3)SiCl4發生水解反應的化學方程式____________________________。
(4)氮化硅(Si3N4)是一種高溫結構材料,粉末狀的Si3N4可以在高溫條件下由SiCl4蒸汽與NH3反應得到,請寫出該反應的化學方程式_____________________________________。
(5)加鋇礦粉調節pH=7的作用是:①使BaCO3轉化為BaCl2;②________________________
(6)生成濾渣A的離子方程式:______________________________;
(7)BaCl2濾液經__________、__________、過濾、洗滌,再經真空干燥后得到BaCl2·2H2O。
(8)10 噸含78.8% BaCO3的鋇礦粉理論上最多能生成 BaCl2·2H2O___________噸。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】如圖裝置可用于驗證氣體的某些化學性質,所得現象和結論均正確的是
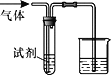
氣體 | 試劑 | 現象 | 結論 | |
A | CH2=CH2 | 溴水 | 溶液褪色 | C2H4能與Br2發生取代反應 |
B | CO2 | BaCl2溶液 | 產生白色沉淀 | CO2能與可溶性鋇鹽反應 |
C | Cl2 | FeCl2溶液 | 溶液變為棕黃色 | 氧化性Cl2>Fe3+ |
D | SO2 | KMnO4溶液 | 溶液褪色 | SO2有漂白性 |
A. A B. B C. C D. D
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com