
【題目】下列物質中,與葡萄糖具有不同最簡式的是
A. 甲醛 B. 蔗糖 C. 甲酸甲酯 D. 果糖
 閱讀快車系列答案
閱讀快車系列答案科目:高中化學 來源: 題型:
【題目】能用能量判據判斷下列過程的方向的是
A.水總是自發地由高處往低處流
B.放熱反應容易自發進行,吸熱反應不能自發進行
C.有序排列的火柴散落時成為無序排列
D.多次洗牌以后,撲克牌的毫無規律的混亂排列的幾率大
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】1molCH2=CH2與HCl完全加成后的產物在光照條件下跟Cl2完全取代,需要標準狀況Cl2的體積是( )
A.44.8LB.67.2LC.89.6LD.112L
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】根據如圖的轉化關系判斷下列說法正確的是(反應條件已略去)( )
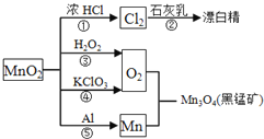
A. 反應①②③④⑤均屬于氧化反應和離子反應
B. 反應⑤說明該條件下鋁的還原性強于錳
C. 相同條件下生成等量的O2,反應③和④轉移的電子數之比為1︰1
D. 反應①中氧化劑與還原劑的物質的量之比為1︰4
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】硫酸鈉和硫酸溶液等體積混合后,H+濃度為0.3molL-1,SO42—濃度為0.4mol·L-1,則混合溶液中Na+濃度為
A. 0. 15 mol·L-1 B. 0.2 mol·L-1 C. 0.25molL-1 D. 0.5 mol·L-1
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】設NA為阿伏加德羅常數的數值,下列說法正確的是
A. 常溫下,23gNO2含有NA個氧原子
B. 1molL—1NaCl溶液含有NA個Na+
C. 標準狀況下,22.4L鹽酸含有NA個HC1分子
D. 等物質的量的CO2與CO,前者比后者多NA個氧原子
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】某混合溶液中溶質所含離子的物質的量濃度如表,則下列有關說法不正確的是( )
溶質所含離子 | SO42﹣ | M | Mg2+ | Fe2+ |
物質的量濃度 | c | 3 | 3 | 2 |
A.若M是NO3﹣ , 則c為3.5
B.若使Fe2+濃度降低,可以加入試劑NaOH
C.若M是NH4+ , 則配制溶液所用的溶質不一定是3種
D.若加入BaCl2溶液能產生兩種沉淀,則M可能是CO32﹣
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】鈦(Ti)被譽為21世紀金屬。冶煉鈦的主要原料是含Fe2O3的鈦鐵礦(FeTiO3),其生產過
程如圖:

已知:TiOSO4可溶于水且易水解,H2TiO3難溶于水。試回答下列問題:
(1)步驟②的主要實驗操作是冷卻、結晶、_________(填操作名稱);步驟④在實驗室中常將試劑置于___________(填儀器名稱)中加強熱。
(2)步驟③中加入熱水的作用是__________________________________。
(3)步驟④中硫酸亞鐵晶體(FeSO47H2O)在空氣中煅燒生成鐵紅、水和三氧化硫,寫出該反應的化學方程式______________________________________________________________。
(4)步驟②所得到的硫酸亞鐵晶體(FeSO47H2O)是目前工業上處理含鉻有毒廢水常用的化學試劑,二者反應后(Cr由+6價轉化為+3價)可以轉化為有重要工業價值的鐵氧體復合氧化物(常用FeOFeyCrxO3表示)。欲制備該鐵氧體復合氧化物,試求在酸性的含鉻廢水中,加入FeSO47H2O的物質的量應為廢水中六價鉻(相當于CrO3)的物質的量的__________倍。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】某同學發現,純度、質量、表面積都相同的兩鋁片與c(H+)濃度相同的鹽酸和硫酸在同溫同壓下反應時產生氫氣的速率差別很大,鋁與鹽酸反應速率更快。他決定對其原因進行探究。
填寫下列空白:
(1)該同學認為:由于預先控制了反應的其他條件,那么,兩次實驗時反應的速率不一樣的原因,只有以下五種可能:
原因Ⅰ:Cl對反應具有促進作用,而![]() 對反應沒有影響;
對反應沒有影響;
原因Ⅱ:________________________________________;
原因Ⅲ:Cl對反應具有促進作用,而![]() 對反應具有阻礙作用;
對反應具有阻礙作用;
原因Ⅳ:Cl、![]() 均對反應具有促進作用,但Cl影響更大;
均對反應具有促進作用,但Cl影響更大;
原因Ⅴ:_____________________________。
(2)該同學設計并進行了兩組實驗,即得出了正確的結論。他取了兩片等質量、外形和組成相同、表面經過砂紙打磨的鋁片,分別放入到盛有同體積、c(H+)相同的稀硫酸和鹽酸的試管(兩試管的規格相同)中:
①在盛有硫酸的試管中加入少量NaCl或KCl 固體,觀察反應速率是否發生變化;
②在盛有鹽酸的試管中加入少量Na2SO4或K2SO4固體,觀察反應速率是否發生變化。若觀察到實驗1中__________,實驗2中__________,則說明原因Ⅲ是正確的。以此類推,該同學通過分析實驗現象,得出了結論:Cl對反應具有促進作用。
(3)為了使實驗”定量化”,使結果更精確,可以對實驗進行如下改進:
①配制c(H+)相同的稀鹽酸和稀硫酸:現有濃度為1 mol L1的鹽酸和密度為1.225 g cm3、質量分數為20%的硫酸,若要準確量取該硫酸20.00 mL,需要用酸式滴定管(一種能夠精確測量溶液體積的儀器)將量取的硫酸配制成c(H+)=l molL1的溶液,可得溶液的體積為________________________________。配制溶液時還需要用到的玻璃儀器有______________、燒杯、膠頭滴管和量筒等。
②比較反應速率:反應時間可以用停表測定。如果要對上述實驗中的反應速率進行比較,可以通過測定哪些物理量來確定?要求回答一種即可。_______________________________________。
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com